Acetilcolinesterasa
L'acetilcolinesterasa o Colinesterasa en glòbuls vermells (AChE), és un enzim humà de la família de colinesterases que es troba en la unió neuromuscular, el sistema nerviós colinèrgic on la seva funció serveix per acabar la transmissió sinàptica i en els glòbuls vermells. La seva funció principal és degradar mitjançant hidròlisi al neurotransmissor acetilcolina produint colina i un grup acetat.[1] En els glòbuls vermelles constitueix un antigen cel·lular anomenat Yt.[2]
Centre actiu i activitat catalítica[modifica]
L'enzim AChE és una hidrolasa de serina; més concretament hidrolitza l'acetilcolina a colina i acetat. El seu mecanisme d'acció es basa en l'acilació i desacilació d'un residu de serina en el centre actiu de l'enzim.[3]
Pel que fa a l'estructura del centre actiu, el seu lloc catalític (format pels aminoàcids directament implicats en la reacció) conté una serina, una histidina i un glutamat; aquesta part del centre actiu es troba en un estreta obertura de 20Å de profunditat (més de la meitat de l'enzim) al voltant de la qual es troben 14 residus aminoacídics aromàtics. Aquests últims contribueixen en la direcció del substrat cap el mateix centre catalític.[4]
L'estructura del centre actiu de l'enzim està condicionada a l'estructura del substrat, és a dir, ambdues es complementen. Així, es distingeixen en el centre actiu de l'AChE un sublloc aniònic i un sublloc éster. El primer, s'encarrega d'atreure per forces electroestàtiques el grup amoni de l'Acetilcolina, i també d'establir interaccions hidrofòbiques amb els grups metil del nitrogen quaternari de la colina, fet que permet l'orientació adequada del substrat. D'altra banda, el sublloc éster trenca l'enllaç éster.[3]
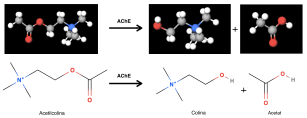
La reacció que protagonitza l'acetilcolinesterasa és una substitució nucleòfila; consisteix en desplaçar la colina de l'acetilcolina, i el grup hidroxil de la serina és finalment acetilat.[3] En la primera etapa de la reacció, el residu de serina del centre actiu reacciona amb l'acetilcolina, el que provoca l'aparició d'un compost intermedi acetil-enzim i l'alliberació de la colina. En la segona etapa, es produeix l'hidròlisi de l'espècie acetil-enzim, que dona pas a la regeneració de l'AChE i a la lliberació de la colina.[5]
Estructura i variants[modifica]
L'acetilcolinesterasa, com a enzim (entre altres funcions), té una estructura proteica que es troba associada a altres parts no proteiques. Les diferents estructures d'aquest enzim estan associades a molècules glucídiques, per tant formen part de la família de les glicoproteïnes.
Més concretament, se sap que aquest l'acetilcolinesterasa està formada per més de 500 aminoàcids. D'altra banda, pel que fa a l'estructura secundària, està formada per 12 làmines β centrals envoltades per 14 hèlixs α que, espacialment, construeixen una forma d'el·lipsoide.[3]
En segon lloc, tot i ser una molècula gran, l'acetilcolinesterasa té una flexibilitat molt reduïda, encara que presenta zones específiques amb certa flexibilitat, especialment al centre actiu de l'enzim.
L'acetilcolinesterasa està codificada per un sol gen, del qual se'n deriven les seves 3 formes, és a dir; un mateix gen codifica les diferents estructures moleculars. Així doncs, aquest enzim presenta polimorfisme. Aquestes variants de l'enzim són les que es presenten a continuació:
- AChE-T. És coneguda d'aquesta manera, ja que és acetilcolinesterasa amb cua sinàptica (de l'anglès talied). Les formes més comunes de l'AChE-T són les globulars i asimètriques. Aquesta és l'única forma present en la transmissó sinàptica i en el teixit muscular.
- AChE-R. Aquesta forma variant s'anomena de traducció completa, i està conformada per dues isoformes monomèriques.
- AChE-H. Aquesta última variant és coneguda com a hidrofòbica o d'eritròcits (AChE-E), ja que és molt present en la membrana d'aquestes cèl·lules. L'estructura de l'AChE-H és de dos dímers amfifílics.[4]
Estructura quaternària de l'AChE
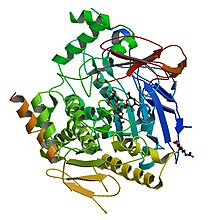
Acetilcolinesterasa (AChE) s'expressa com una congregació de formes moleculars que difereixen en l'estructura quaternària i manera d'ancoratge, el patró varia d'un teixit a un altre, i pot reflectir l'espai i el temps en els requeriments de sinapsi individuals. Aquest polimorfisme estructural sorgeix d'una unió alternativa al C-terminal, que facilita l'associació amb proteïnes estructurals. La unió T de la variant (AChE-T) és l'única forma expressada en el cervell i els músculs de mamífers adults normals, generant monòmers, dímers i tetràmers, així com una cua de col·lagen. Les espècies funcionals d'AChE en les sinapsis colinèrgiques dels vertebrats estan formades per quatre subunitats d'AChE-T associades a la proteïna de col·lagen ColQ, o amb una proteïna d'ancoratge de membrana rica en prolina transmembrana (PRiMA).[4]
Aquestes formes hetero-oligomèriques d'AChE-T i espècies homòlogues són estructures úniques. En les espècies de cua de col·lagen, un, dos o tres tetràmers d'AChE-T s'uneixen als tres fils de col·lagen. Cadascuna d'aquestes formes hetero-oligomèriques són asimètriques, és a dir, dues subunitats d'AChE estan unides per disulfur a través dels seus residus Cys C-terminals, mentre que el residu Cys corresponent a les altres dues subunitats fan enllaços disulfur amb la cadena de col·lagen.[6]
L'estructura quaternària es manté fins i tot quan tots els disulfurs entre cadenes es redueixen. Els monòmers AChE-T s'acoblen en tetràmers estables en presència de poliprolina sintètica o PRAD domini d'enllaç ric en prolina sense formació d'enllaços disulfur. Aquesta interacció requereix la seqüència C-terminal i T d'alta conservada d'AChE-T la qual forma una hèlix amfipàtica que es diu WAT (tetramerització anfífila triptófana), a causa de la presència de tres residus de triptòfan (Trp) altament conservats. Per tant, l'acoblament de quatre subunitats d'AChE-T amb una cadena ColQ es basa en les interaccions entre les seqüències WAT i PRAD. Les mutacions de les cisteïnes involucrades en la formació d'enllaços disulfur entre cadenes va proporcionar evidència que les cadenes WAT estan orientades antiparal·leles a la PRAD.[7]
Altres activitats de l'enzim AChE[modifica]
Actualment diversos indicis fan pensar que aquest enzim presenta més funcions no enzimàtiques paral·lelament a la seva funció principal o clàssica, esmentada anteriorment (activitat catalítica). Alguns dels indicis que donen lloc a aquesta idea són la seva amplia distribució, trobat en organismes unicel·lulars, plantes, invertebrats i vertebrats,[3] durant la embriogènesi primerenca, el desenvolupament muscular, l'extensió embrionària de neurites, abans de la sinaptogènesi, en cèl·lules neoplàstiques hematopoètiques, osteogèniques, en neurones adultes no colinèrgiques, etc.[5]
A continuació es presenten algunes de les múltiples activitats de la AChE, investigades i confirmades per diversos grups de professionals:
- Neurogènesi. La AChE presenta un paper important a la neurogènesi. AChE purificada d'origen extern va promoure el creixement de neurites de les cèl·lules nervioses en un cultiu de pollets. Diversos inhibidors del centre actiu no podien atenuar aquest efecte, pel contrari un inhibidor del lloc perifèric (no catalític) bloquejà la neurogènesi. Posteriorment, aquesta activitat neurogènica s'ha observat en cèl·lules de neuroblastoma, en cèl·lules de feocromocitoma (PC12), entre d'altres,[5] fet que suggereix una activitat tròfica de la AChE independentment de l'activitat catalítica.[3]
- Adhesió cel·lular. La AChE presenta una elevada similitud amb proteïnes relacionades amb l'adhesió cel·lular (glutactina, neurotactina, gliotactina y neuroligines).[3] Aquestes proteïnes de membrana participen en la formació i diferenciació de les unions cel·lulars, i presenten un domini extracel·lular amb una seqüència homòloga a l'AChE (seqüència de colinesterasa, CE)[3] que presenta una estructura tridimensional pràcticament idèntica a la de la AChE. D' aquesta forma, en un estudi en el qual es van usar cèl·lules de Drosophila, quan es va substituir el domini CE d'una proteïna d'adhesió, per l'homòleg d'AChE de Drosophila, les propietats adhesives es van mantenir. De totes maneres, la participació d'AChE en aquestes interaccions continua investigant-se.[5]
- Activació de neurones dopaminergènicas. S' ha demostrat que AChE purificada i recombinada presenta una activitat autocrina que millora l'alliberament de dopamina de les neurones dopaminergènicas. Aquest fenomen es segueix estudiant però pot resultar tenir una important rellevància fisiològica.[5]
- Assemblatge de fibra amiloide. AChE promou la unió i formació de fibres amiloide, fet que requereix una alta concentració d'AChE, el que pot ser una limitació important. Aquesta activitat és bloquejada per l'inhibidor del lloc perifèric però no pel del centre actiu, el que indica que es tracta d'una funció no clàssica. L'AChE s' uneix a les fibril·les amiloides tant in vitro com in vivo.[5]
- Hematopoesis i trombopoesis. Les activitats hematopoètiques i trombopoètiques de l'AChE s'expliquen a causa de la trobada d'aquest enzim en progenitors de cèl·lules sanguínies. S'ha demostrat com arrel de l'activació, induïda per hemaglutinina, de limfòcits, es dona l'activació transcripcional d'AChE.[5]
És important saber que el bloqueig de la seva activitat hidrolítica o catalítica no dona lloc necessàriament al bloqueig de les seves altres funcions.[5]
Regulació de l'expressió d'AChE. Transcripció[modifica]
La heterogeneïtat funcional que presenten les tres variants de l'AChE és regulada pels canvis en els nivells transcripcional, post-transcripcional i post-traduccional.[3] D'aquests depenen la condició fisiològica, l'estat de diferenciació, l'especificitat de tipus cel·lular i la resposta davant dels estímuls. Per exemple, el tall i entroncament seqüencial del pre-ARNm de l'AChE junt amb la regulació dels extrems 5’ i 3’ donen lloc a una regulació específica de l'expressió d'AChE que provoca respostes ràpides davant estímuls externs.[5]
La diferenciació cel·lular, un baix nivell d'AChE i l'excitació a través de l'acetilcolina degut al contacte amb anti-AChE són senyals que indueixen la transcripció d'AChE. També s'ha descobert que l'estrés psicològic, estímuls ambientals i lesions al cap afavoreixen el nivell de transcripció de l'enzim.[5]
Per últim, i més relacionat amb la seva funció principal hidrolítica, quan es produeix l'alliberament d'acetilcolina, per tal d'esmorteir la neurotransmisió excessiva provocada per aquesta cap a nivells normals, es produeix l'excitació i sobreexpressió per retroalimentació d'AChE. L'activació transcripcional també afecta les funcions no clàssiques de l'enzim.[5]
Distribució entre les espècies[modifica]
L'acetilcolina es troba en els eucariotes incloent com a mínim algunes plantes.[8]
Patologies[modifica]
La modulació de l'activitat de l'acetilcolinesterasa és una de les maniobres terapèutiques per alleugerir les funcions cognitives en pacients amb Alzheimer.[9]
L'acetilcolinesterasa és l'objectiu del gas nerviós, i dels insecticides organofosforats els quals bloquegen la seva acció causant una contracció muscular.
Referències[modifica]
- ↑ Soreq H, Seidman S «Acetylcholinesterase--new roles for an old actor.». Nat. Rev. Neurosci., 2, 4, 2001, pàg. 294-302. DOI: 10.1038/35067589. PMID: 11283752.
- ↑ «Entrez Gene: ACHE acetylcholinesterase (Yt blood group)». [Consulta: 1r abril 2008].
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 Sánchez-Chávez, Gustavo; Salceda, Rocío «Enzimas polifuncionales: el caso de la acetilcolinesterasa». Revsita de educación bioquímica, 27, 2008, pàg. 41-50.
- ↑ 4,0 4,1 4,2 Dvir, Hay; Silman, Israel; Harel, Michal; Rosenberry, Terrone L.; Sussman, Joel L. «Acetylcholinesterase: From 3D structure to function». Chemico-Biological Interactions, 187, 2010, pàg. 12-13.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 Soreq, Hermona; Sholmo, Seidman «Acetylcholinesterase—new roles for an old actor.». Nature Reviews Neuroscience, 2, 2001, pàg. 294-302.
- ↑ S. Bon, A. Ayon, J. Leroy, J. Massoulié «Massoulié, Trimerization domain of the collagen tail of acetylcholinesterase». Neurochemical Research, 28, 3-4, 2003, pàg. 523–535.
- ↑ Bon, S., Dufourcq, J., Leroy, J., Cornut, I. and Massoulié «The C-terminal t peptide of acetylcholinesterase forms an α helix that supports homomeric and heteromeric interactions». European Journal of Biochemistry, The C-terminal t peptide of acetylcholinesterase forms an α helix that supports homomeric and heteromeric interactions, 2004, pàg. 33–47. DOI: 10.1046/j.1432-1033.2003.03892.x.
- ↑ Momonoki YS «Occurrence of Acetylcholine-Hydrolyzing Activity at the Stele-Cortex Interface». Plant Physiol., 99, 1, maig 1992, pàg. 130–133. DOI: 10.1104/pp.99.1.130. PMC: 1080416. PMID: 16668839.
- ↑ Pakaski M, Kasa P «Role of acetylcholinesterase inhibitors in the metabolism of amyloid precursor protein.». Current drug targets. CNS and neurological disorders, 2, 3, 2003, pàg. 163-71. PMID: 12769797.
