Ceratina
 | |
| Substància | grup o classe de proteïnes |
|---|---|
Les ceratines o queratines són una família de proteïnes no solubles en aigua, fibroses i de funció estructural amb la capacitat d'endurir extremadament el teixit en el qual s'acumula (banyes del rinoceront). Els teixits carregats de queratina s'anomenen queratinitzats o cornificats. En l'ésser humà la trobem a l'epidermis, ungles o cabell. Formen part dels filaments intermedis[1] del citoesquelet d'animals i les estructures dures no mineralitzades de mamífers, aus, amfibis i rèptils.[2]
Funció[modifica]
La funció principal de la queratina és la de component estructural, es troba present en les capes més externes de l'epidermis dels vertebrats i en altres òrgans derivats de l'ectoderma com són pèls, ungles, plomes, banyes, peülles (α-queratines) o closques de tortugues (β-queratines) als quals proporciona duresa i resistència.[3]
La queratina als cabells[modifica]
Els cabells, constituïts principalment de queratina, deuen la seva forma als ponts disulfur formats entre les diferents fibres. Llavors mitjançant diferents formes de trencar aquests enllaços i tornar a fer-los amb una disposició diferent podem canviar de forma dels cabells. Les planxes pels cabells en són un exemple, ja que amb l'energia que proporcionen trenquen els enllaços, que es tornaran a fer amb una disposició diferent que permetrà que es mantinguin llisos.
La queratina dels cabells es troba en forma de macrofibril·les. L'estructura secundària en forma de α-hèlix s'entrellacen en grups de tres per formar protofibril·les. Aquestes es disposen en grups d'11 en els quals 9 protofibril·les envolten dues altres i donen lloc a una microfibril·la. I per finalitzar, centenars de microfibril·les s'acoblen per formar una macrofibril·la de queratina.
Les macrofibril·les esmentades s'empaqueten amb cèl·lules capil·lars mortes creant una fibra capil·lar (un cabell).[4]
El monilethrix es una displàsia pilosa hereditària transmesa en la majoria dels casos de forma autosòmica dominant i causada per mutacions en els gens localitzats al cromosoma 12q11q13 que codifiquen les queratines piloses corticals de tipus II.[5] Una altra malaltia rara congènita amb diverses variants que altera l'estructura del tall pilós, originada per una mutació sense sentit en el gen K71[6] i de vegades acompanyada d'alteracions cutànies o extracutànies, és la síndrome del cabell llanut.[7]
Filaments intermedis[modifica]
Hi ha diferents tipus de filaments intermedis que varien en la seva constitució depenent del tipus cel·lular en el qual es troben. Els filaments intermedis de tipus I i II són aquells que estan formats de queratina i es troben a les cèl·lules del teixit epitelial. Aquests filaments intermedis formats de queratina participen en la formació d'unions intercel·lulars i permeten que tant el teixit com la cèl·lula en si mateixa tinguin una certa resistència mecànica.[8]
La queratina també té un rol important en la determinació de la mida de la cèl·lula, la seva proliferació, el transport dels organels, ja que constitueix part del citoesquelet.
Teixits queratinitzats[modifica]
El teixit epitelial és on predomina la queratina amb molta diferència en relació a l'existent en altres tipus de teixits.[9] El fet que la presència de queratina determini la classificació d'alguns tipus de teixits epitelials (epiteli estratificat no queratinitzat i epiteli estratificat queratinitzat) dona a entendre la importància que té dita proteïna en aquesta categoria cel·lular.[10]
A les capes basals de l'epiteli estratificat queratinitzat es troben les cèl·lules mare epitelials que donaran lloc als queratinòcits de les capes superiors. A mesura que es van diferenciant les cèl·lules es van queratinitzant i van migrant cap a les capes exteriors.
Les queratines alfa (epitelials) es poden classificar como dures o blanes segons el seu contingut de sofre (present a les cisteïnes). Aquelles queratines alfa que tenen un elevat contingut en sofre són les dures i són aquelles que es troben al cabell. En canvi les que tenen un baix contingut en sofre són les blanes (molt més flexibles) i es troben a la pell.[11][12]
Procés de queratinització[modifica]
El procés de queratinització al teixit epitelial és l'aparició de grànuls de queratina al citoplasma de les cèl·lules epitelials paralel·lament al seu envelliment a conseqüència del mateix metabolisme cel·lular. Finalment el nucli acaba desapareixent i es va perdent tot el líquid fins que les cèl·lules queden totalment queratinitzades. Aquestes cèl·lules completament queratinitzades i mortes formen a la capa externa de la pell una capa protectora.
Exemples clínics[modifica]
Carcinoma de cèl·lules escatoses: El SCC és una forma de càncer que pot donar-se a molts òrgans diferents, com ara el pulmó o l'úter.[13][14] És la formació d'un tumor maligne a l'epiteli degut a la seva queratinització excessiva y descontrolada. L'excés de queratina es veu reflectit en la presència de queratina intraepitelial. Representa un 20% dels càncers cutanis no melanocítics i metastatitza amb molta facilitat.[15]
La queratina a l'epidermis humana[modifica]
Al cos humà, la presència de la queratina és molt important a l'epidermis. Això és el que els garanteix una pell impermeable als mamífers. Efectivament, moltes de les propietats de la pell resulten de l'expressió de la queratina. Té la funció de protegir les cèl·lules contra els estressos mecànics i pot actuar també com a plataforma senyalitzadora. Així doncs existeix un estret lligam entre la plasticitat dels filaments de queratina i la fisiologia de l'epidermis.
Hi ha principalment quatre formes de la queratina a l'epidermis humana que són les de massa molecular 50, 56.5, 58, i la 65-67 kD que poden ser dividides en dues subfamílies: l'àcida i la bàsica. Les proteïnes de cada subfamilia han d'unirse a una proteïna de l'altra subfamilia per poder constituir filaments.[16] Diverses observacions per microscopia electrònica de queratina dels grups àcids i bàsics ens han mostrat que dins de cada subfamília la queratina forma estructures diferents oligomèriques, però que els dímers de queratina i els assemblaments més importants d'aquestes proteïnes només es formen quan es combinen elements de les dues famílies. Així doncs tan sols són necessàries dues proteïnes de queratina de cada subfamilia i el seu assemblament per la formació de dímers de queratina.[17]
En la psoriasi es produeix una hiperproliferació dels queratinòcits cutanis que origina les lesions escatoses característiques de la malaltia, com a conseqüència de l'activació de les cèl·lules T davant certs antígens, els quals encara no estan ben determinats.[18] Les ictiosis són un grup de malalties de la pell que poden ser de naturalesa hereditària o adquirida. La ictiosi vulgar és la més freqüent d'entre les moltes del grup (més de vint identificades ara per ara) que tenen un origen congènit, té una prevalença d'1 cas/250-1.000 persones, un patró de transmissió familiar autosòmic dominant i està provocada per mutacions inactivants del gen que codifica la filagrina.[19][20] La ictiosi adquirida és una entitat clínica molt poc habitual i que apareix en adults associada a una altra patologia subjacent, sovint de tipus neoplàsic, la qual modifica algun dels factors que intervenen en el procés de queratinització.[21][22]
Estructura[modifica]
La queratina és una proteïna en estructura secundària. La seva forma en tres dimensions és el resultat del plegament de l'estructura primària original sobre si mateixa fins a adquirir la forma en espiral d'una proteïna en hèlix alfa per acció de ponts d'hidrogen i forces hidròfobes existents entre els aminoàcids que la conformen. Aquesta estructura confereix la duresa característica de la proteïna.
L'estructura primària[modifica]
Als éssers humans hi ha 54 gens funcionals que codifiquen per queratines, que es classifiquen en dues famílies diferents però homòlogues: les queratines de tipus I (subfamília A) i les de tipus II (subfamília B). Als cromosomes humans 17q21 i 12q13 hi ha sengles conjunts de 27 gens que codifiquen per les queratines de tipus I i les de tipus II respectivament. Aquests tipus diferents de queratines comparteixen un 30% d'estructures homòlogues en dominis centrals d'aproximadament 310 residus en contraposició amb les regions de terminals amino (N-terminal) i carboxil (C-terminal) que mostren una gran varietat en les diverses proteïnes.
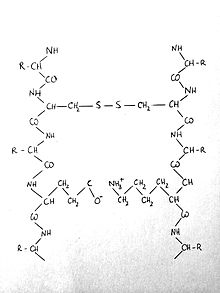
Aquestes diferències tan significatives entre els terminals dels dos tipus de queratines tenen com a conseqüència que les seves mides i punts isoelèctrics siguin diferents: les de tipus I són més petites (estan compostes per uns 460 aminoàcids) i acídiques i les de tipus II són llargues (uns 545 aminoàcids) i tenen un comportament més aviat bàsic. Les queratines àcides tenen un punt isoelèctric que va 4,9 a 5,4 en humans i és inferior a 5,6 en bovins mentre que les bàsiques el tenen entre 6,5 i 8,5 en humans i superior a 6 en bovins. Excepcionalment, les queratines específiques del cabell, les ungles i la llana tenen un punt isoelèctric entre 4,7 i 5,4.
L'estructura primària de la queratina pot variar en nombre i seqüència d'aminoàcids, polaritat, càrrega i mida, tanmateix les seqüències d'aminoàcids entre queratines concretes d'espècies diferents acostumen a ser similars. S'ha vist que tant a les queratines de la pell dels humans com les de les rates i els bovins predominen els aminoàcids glicina, serina, leucina i àcid glutàmic.
Les funcions i propietats del filament de queratina vindran determinats per l'ordre de la cadena d'aminoàcids, fins a tal punt que es pot donar el cas que la posició d'un sol aminoàcid influeixi en l'estructura tridimensional de la molècula sencera. La seqüència d'aminoàcids també determina les estructures secundàries, terciàries i quaternàries de la queratina així com el tipus d'interaccions que tindrà amb altres molècules del citoesquelet.
L'estructura secundària[modifica]
Com ja s'ha dit prèviament, tant la queratina de tipus I com la de tipus II tenen uns dominis centrals d'uns 310 residus. Aquest dominis estan composts per quatre segments (1A, 1B, 2A i 2B) en forma d'hèlix alfa lligats per tres segments (L1, L12 i L2) més petits amb una conformació no-helicoidal. En queratines de tipus I tots els segments estan carregats negativament mentre que en les de tipus II hi ha segments acídics, neutrals i carregats positivament.
Pel que fa als extrems de les queratines hi ha el domini del cap (N-terminal) i el de la cua (C-terminal). Aquests tres grans dominis (cap, part central i cua) estan dividits en subdominis, que venen donats per la seqüència d'aminoàcids de la queratina particular i determinaran la seva funció.
El domini del cap de la queratina té una estructura helicoidal, no-globular, i una cadena d'entre 50 i 100 aminoàcids de llargada, i tindrà sempre una càrrega neta positiva. Depenent de les propietats dels aminoàcids que el conformin, el cap de la molècula interaccionarà d'una manera o altra amb altres queratines o molècules. Per exemple, en el cas de les cèl·lules epitelials queratinitzades (com serien les del cuir cabellut), el domini del cap té moltes cisteïnes que formen ponts disulfur amb altres queratines.
La cua de les queratines té una estructura globular no-helicoidal i està dividida en subdominis depenent del tipus de molècula. Les queratines bàsiques tenen tres subdominis anomenats H2, V2 i E2. D'altra banda, les àcides només tenen dos subdominis: V2 i E2. El domini de la cua acostuma a estar implicat en la formació dels filaments de queratina, encara que no sempre és així.[23]
L'estructura terciària[modifica]
L'estructura terciària de la queratina és un heterodímer i la seva formació és el primer pas per la construcció de filaments de queratina. Aquests heterofilaments estaràn formats per queratines I i II en iguals proporcions. A partir d'observacions in vitro s'ha observat que els heterodímers són les configuracions més estables de la queratina que constitueixen els filaments. Els heterodímers segueixen sent solubles en el citoplasma de la cèl·lula però aquesta solubilitat dependrà de la varietat de la queratina implicada i de les característiques químiques del citoplasma.
L'estructura quaternària[modifica]
La queratina pot formar també filaments amb una complexa estructura quaternària entre les quals trobem tetràmers de 10 nm i octàmers de 4,5 nm i fins i tot unitats de filaments d'uns 20 nm de diàmetre als que anomenem protofibrilles. El tetràmer es forma a partir de l'alineament de manera antiparalela de dos heterodímers. Els ponts que es creen per l'acció de les càrregues dels heterodímers provoquen la unió d'aquests heterodímers. De tota manera es coneixen poc els mecanismes de la creació dels tetràmers. La formació dels tetràmers té lloc a la perifèria de la cèl·lula i la seva estabilitat dependrà de la forforilització de la queratina i del pH del medi. Per exemple els tetràmers que contenen K16 seràn menys estables que els que contenen K14.
Síntesi[modifica]
La queratina és sintetitzada principalment pels queratinòcits, les cèl·lules epitelials més abundants.[24] La cadena polipeptídica (d'uns 300 aminoàcids aproximadament) està caracteritzada per tenir abundant cisteïna que permet que entre elles facin ponts disulfur el que atorga a l'estructura una rigidesa elevada. Un cop la proteïna s'ha sintetitzat, els monòmers de queratina s'uneixen entre si per formar dímers unint-se una subunitat àcida amb una bàsica, així la macromolècula tindrà la mateixa proporció de subunitats bàsiques i àcides. Aquests dímers s'uniran i formaran tetràmers, multitud dels quals formaran un protofilament.
Diversos protofilaments en grups de 4 formaran una protofibril·la. I grups de protofibril·les ben cohesionats formaran les macromolècules de queratina gràcies a l'activitat de la filagrina[25] (al cabell trobem la queratina organitzada de forma diferent que a l'epiteli).
Referències[modifica]
- ↑ Quinlan RA, Schiller DL, Hatzfeld M, Achtstätter T, Moll R, Jorcano JL, Magin TM, Franke WW «Patterns of expression and organization of cytokeratin intermediate filaments». Ann NY Acad Sci, 455, 1, 1985 Oct, pp: 282-306. ISSN 0077-8923. DOI: 10.1111/j.1749-6632.1985.tb50418.x. PMID: 2417517.
- ↑ Wyld, JA; Brush, AH «The molecular heterogeneity and diversity of reptilian keratins». J Mol Evol, 12, 4, 1979 Abr 12, pp: 331-347. ISSN 0022-2844. DOI: 10.1007/BF01732028. PMID: 448748.
- ↑ McKittrick, J; Chen, PY; Bodde, SG; Yang, W; et al «The Structure, Functions, and Mechanical Properties of Keratin». JOM, 2012; 64 (4), pp: 449-468. DOI: 10.1007/s11837-012-0302-8. ISSN: 1047-4838.
- ↑ «www.proteines.org.es» (en castellà).
- ↑ Fontenelle de Oliveira, E; Cotta de Alencar Araripe, AL «Monilethrix: a typical case report with microscopic and dermatoscopic findings» (en anglès). An Bras Dermatol, 2015 Gen-Feb; 90 (1), pp: 126–127. DOI: 10.1590/abd1806-4841.20153357. PMC: 4323712. PMID: 25672313 [Consulta: 11 agost 2020].
- ↑ Hartz, PA; O'Neill, MJF «Keratin 71, type II; KRT71» (en anglès). OMIM, Johns Hopkins University, 2014 Jul 18; 608245 (rev), pàgs: 4 [Consulta: 14 agost 2020].
- ↑ Fujimoto, A; Farooq, M; Fujikawa, H; Inoue, A; et al «A missense mutation within the helix initiation motif of the keratin K71 gene underlies autosomal dominant woolly hair/hypotrichosis» (en anglès). J Invest Dermatol, 2012 Oct; 132 (10), pp: 2342-2349. DOI: 10.1038/jid.2012.154. ISSN: 1523-1747. PMID: 22592156 [Consulta: 11 agost 2020].
- ↑ Birgitte Lane, E «Keratin Intermediate Filaments and Diseases of the Skin». Madame Curie Bioscience Database [Internet]. Landes Bioscience (Austin, TX), 2006; NBK6247, pp: 11.
- ↑ Moll, R; Divo, M; Langbein, L «The human keratins: biology and pathology». Histochem Cell Biol, 2008 Jun; 129 (6), pp: 705–733. DOI: 10.1007/s00418-008-0435-6. PMC: 2386534. PMID: 18461349.
- ↑ Bragulla, HH; Homberger, DG «Structure and functions of keratin proteins in simple, stratified, keratinized and cornified epithelia». J Anat, 2009 Abr; 214 (4), pp: 516–559. DOI: 10.1111/j.1469-7580.2009.01066.x. PMC: 2736122. PMID: 19422428.
- ↑ Parada Puig, R «Queratina: tipos, estructura, localización y funciones» (en castellà). Biología, Lifeder.com, 2019, pàgs: 12 [Consulta: 9 agost 2020].
- ↑ Megías M, Molist P, Pombal MA «Epitelio estratificado plano queratinizado» (en castellà). A: Atlas de histología vegetal y animal: Tejidos animales. Epitelios. Facultad de Biología, Universidad de Vigo, 2019; Des 30 (rev), pàgs: 4 [Consulta: 9 agost 2020].
- ↑ Suárez, E; Knollmann-Ritschel, BEC «Squamous Cell Carcinoma of the Lung» (en anglès). Acad Pathol, 2017 Gen-Des; 4, pp: 2374289517705950. DOI: 10.1177/2374289517705950. PMC: 5528918. PMID: 28815199 [Consulta: 9 agost 2020].
- ↑ Ishida, M; Okabe, H «Superficial spreading squamous cell carcinoma of the uterine cervix involving the endometrium: Report of two cases with emphasis on the likely molecular mechanism» (en anglès). Oncol Lett, 2013 Gen; 5 (1), pp: 31–34. DOI: 10.3892/ol.2012.953. PMC: 3525468. PMID: 23255888 [Consulta: 9 agost 2020].
- ↑ Burton, KA; Ashack, KA; Khachemoune, A «Cutaneous Squamous Cell Carcinoma: A Review of High-Risk and Metastatic Disease» (en anglès). Am J Clin Dermatol, 2016 Oct; 17 (5), pp: 491-508. DOI: 10.1007/s40257-016-0207-3. ISSN: 1175-0561. PMID: 27358187 [Consulta: 9 agost 2020].
- ↑ Eichner, R; Sun, TT; Aebi, U «The role of keratin subfamilies and keratin pairs in the formation of human epidermal intermediate filaments» (en anglès). J Cell Biol, 1986 Maig; 102 (5), pp: 1767-1777. DOI: 10.1083/jcb.102.5.1767. PMC: 2114194. PMID: 2422179 [Consulta: 10 agost 2020].
- ↑ UniProt «Keratin-associated protein 4-1» (en anglès). Protein knowledgebase. UniProt Consortium, 2020 Jun 17; Q9BYQ7 -KRA41_HUMAN- (rev), pàgs: 9 [Consulta: 10 agost 2020].
- ↑ Das, RP; Jain, AK; Ramesh, V «Current concepts in the pathogenesis of psoriasis» (en anglès). Indian J Dermatol, 2009 Gen-Mar; 54 (1), pp: 7-12. DOI: 10.4103/0019-5154.48977. PMC: 2800878. PMID: 20049260 [Consulta: 15 agost 2020].
- ↑ Vega Almendra, N; Aranibar Duran, L «Ictiosis hereditaria: desafío diagnóstico y terapéutico» (en castellà). Rev Chil Pediatr, 2016 Maig-Jun;87 (3), pp: 213-223. ISSN 0717-6228. DOI: 10.1016/j.rchipe.2015.07.025. PMID: 26471314 [Consulta: 18 agost 2020].
- ↑ Thyssen, JP; Godoy-Gijon, E; Elias, PM «Ichthyosis vulgaris: the filaggrin mutation disease» (en anglès). Br J Dermatol, 2013 Jun; 168 (6), pp: 1155–1166. DOI: 10.1111/bjd.12219. PMC: 6317863. PMID: 23301728 [Consulta: 18 agost 2020].
- ↑ Arjona-Aguilera, C; Blasco-Morente, G; Pérez-López, I; Martínez-López, A; et al «Ictiosis adquirida: un signo de malignidad» (en castellà). Actual Med, 2015; 100 (795), pp: 101-102. ISSN 2605-2083. Arxivat de l'original el 29 d'abril 2019. DOI: 10.15568/am.2015.795.cd01 [Consulta: 18 agost 2020].
- ↑ Martín-Cascón, M; Sánchez-Guirao, AJ; Herranz-Marín, MT «Ictiosis adquirida paraneoplásica en adenocarcinoma de pulmón» (en castellà). Arch Bronconeumol, 2015 Nov; 51 (11), pp: 609. ISSN 1579-2129. DOI: 10.1016/j.arbres.2015.05.008. PMID: 26143135 [Consulta: 18 agost 2020].
- ↑ «Proteopedia» (en anglès).
- ↑ Freedberg, IM; Tomic-Canic, M; Komine, M; Blumenberg, M «Keratins and the Keratinocyte Activation Cycle» (en anglès). J Invest Dermatol, 2001 Maig; 116 (5), pp: 633-640. DOI: 10.1046/j.1523-1747.2001.01327.x. ISSN: 1523-1747. PMID: 11348449 [Consulta: 14 agost 2020].
- ↑ UniProt «Filaggrin» (en anglès). Protein knowledgebase. UniProt Consortium, 2020 Jun 17; P20930 -FILA_HUMAN- (rev), pàgs: 19 [Consulta: 11 agost 2020].
Bibliografia[modifica]
- Uitto, Jouni; Richard, Gabriele; McGrath, John A. Diseases of epidermal keratins and their linker proteins (en anglès). Exp Cell Res, 2007 Jun 10; 313 (10), pp: 1995-2009. PMID: 17531221. DOI 10.1016/j.yexcr.2007.03.029 [Consulta: 14 agost 2020].
- Shetty, Shibani; Gokul, Sridharan. Keratinization and its Disorders (en anglès). Oman Med J, 2012 Set; 27 (5), pp: 348–357. PMID: 23074543. DOI 10.5001/omj.2012.90 [Consulta: 14 agost 2020].
- Haines, Rebecca L.; Lane, E. Birgitte. Keratins and disease at a glance (en anglès). J Cell Sci, 2012 Set 1; 125 (Pt 17), pp: 3923-3928. PMID: 23104737. DOI 10.1242/jcs.099655 [Consulta: 22 agost 2020].
- Swain, Niharika; Routray, Samapika; Hosalkar, Rashmi; Iyer, Janaki; Thakur, Mansee. Keratin (en anglès). A: Encyclopedia of Signaling Molecules (Choi, S; Ed.) Springer Science+Business Media, LLC, 2018; 2ª Edició, pàgs: 8. ISBN 978-3-319-67198-7. DOI 10.1007/978-3-319-67199-4 [Consulta: 22 agost 2020].
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Ceratina |
- Keratin protein Shomu's Biology. 2012 Nov (en anglès)
- Lifecycle of the Keratinocyte Pastiche Training. 2017 Maig (en anglès)
