Cetona
| Substància química | classe estructural d'entitats químiques |
|---|---|
| Estructura química | |
 | |
Una cetona és un compost orgànic que conté el grup funcional carbonil enllaçat a dos radicals alquil o, en les cetones cícliques, formant part d’una cadena alifàtica tancada. Una cetona està representada doncs per la fórmula general . Les cetones més simples, fins a uns dotze àtoms de carboni, són líquides. Les de massa molecular més baixa són solubles en aigua; totes ho són en dissolvents orgànics. Són destil·lables sense descomposició, i d’olor etèrica o aromàtica.
Història[modifica]

El nom «cetona» per referir-se a un grup de composts químics fou introduït el 1848 pel químic alemany Leopold Gmelin (1788–1853) a partir del mot francès acétone, acetona.[1] EI mot «acetona» és del 1833, i literalment significa «derivat de l'àcid acètic», del llatí acetum vinagre, més el sufix «–ona».[2]
L'acetona és la més simple de les cetones i ja fou descoberta durant l'edat mitjana pels alquimistes, que l'anomenaven «esperit de Saturn». Fou el químic francès Jean Baptiste Dumas (1800–1884) i el químic alemany Justus von Liebig (1803–1873), qui determinaren la seva fórmula. El químic francès Antoine Bussy (1894–1882) l'any 1833 l'anomenà «acetona» per suggeriment de Louis Jacques Thenard (1777–1857) i Michel Eugène Chevreul (1786–1889), i proposà una nomenclatura pels composts semblants que acabessin en «–ona» i amb l'arrel de l'àcid d'on s'obtenien.[3]
Estat natural[modifica]

Moltes cetones es troben en la natura desenvolupant diferents funcions en els éssers vius. Per exemple, en els vegetals hom troba la càmfora, una cetona terpènica que s'extreu de la fusta del camforer, així com de moltes altres plantes,[4] i que s'empra com insecticida contra les arnes; la carvona, la pulegona, la mentona i la verbenona, totes cetones terpèniques;[5] la jasmona, hom la troba a l'oli de Jasminum officinale;[6] l'isoforona, present al nabiu de grua; les ionones, damascones i damascenones són presents en olis essencials.[7]
En el regne animal en són exemples l'heptan-2-ona, un dels components de la feromona d'alarma de les abelles; la muscona, responsable de l'olor del mesc; i la civetona, present en les glàndules perineals de la civeta africana (Civettictis civetta).[8] En el éssers humans són cetones les hormones sexuals femenina progesterona i la masculina testosterona. També presenten grups carbonils altres hormones esteroidals, com ara la cortisona, la hidrocortisona, l'androstendiona, la dihidrotestosterona, l'aldosterona i l'estrona. Totes tenen noms comuns acabats en «–ona», terminació característica de les cetones.[9]
Nomenclatura[modifica]
-
Butan-2-ona o cetona etil metílica.
Segons les regles de la IUPAC, les cetones s’anomenen de manera substitutiva afegint un sufix com ara «–ona» o «–diona» al nom de l’hidrur fonamental (propà, butà...), amb l’addició de la «n» etimològica, com ara propanona, butan-2-ona, hexan-3,4-diona. Si un grup té prioritat d’esment com a grup característic principal, la cetona es descriu amb el prefix «oxo–». Per exemple àcid 3-oxopentanoic.[10]
Els noms de classe funcional per a monocetones i cetones veïnes, etc., es formen esmentant el nom de classe cetona, dicetona, etc., com a paraula separada, seguit dels noms de prefix, per ordre alfabètic, per als dos grups units al grup o als grups carbonil, adjectivant el darrer. Així s'obtenen noms com: cetona etil metílica, cetona metil pentílica, dicetona benzil etílica.[10]
Les dicetones derivades d’hidrurs fonamentals cíclics que tenen el nombre màxim de dobles enllaços no acumulats per conversió de dos grups –CH= en grups >CO, amb la transposició de dobles enllaços en una estructura quinoide, es poden anomenar, alternativament, afegint el sufix «–quinona» al nom de l’hidrur fonamental aromàtic. Són exemples crisen-5,6-quinona o crisen-5,6-diona.[10]
Propietats[modifica]
Propietats físiques[modifica]
En general, les cetones tenen punts d'ebullició més alts que els dels alquens, perquè són més polars, i són més intenses les forces d'atracció dipol-dipol entre les molècules. Però tenen punts d'ebullició menors que els dels alcohols perquè, a diferència dels alcohols, dos grups carbonil no poden formar enllaços per ponts d'hidrogen entre si. L'oxigen carbonílic de les cetones pot formar enllaços per ponts d'hidrogen amb els protons dels grups hidroxil . Això els fa més solubles en aigua que els alquens, això no obstant, són menys solubles que els alcohols.[6]
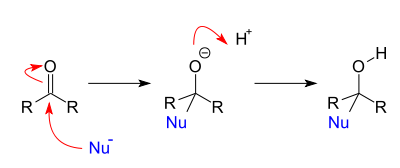
Propietats químiques[modifica]
Els aldehids i les cetones es comporten com a àcids a causa de la presència del grup carbonil, això fa que es presentin reaccions típiques d'addició nucleòfila. Un àtom o grup polaritzat negativament ataca el carboni polaritzat positivament del grup carbonil, al pas determinant de la velocitat d'aquestes reaccions. Per exemple, els reactius de Grignard o els d'organoliti, l'hidrur d'alumini i liti i el borohidrur de sodi , reaccionen amb els compostos carbonílics per addició nucleòfila. També poden donar origen a compostos halogenats substituint un o diversos hidrògens del carboni per halògens.[6]

Reducció a alcans[modifica]
S'empren dos mètodes per reduir els grups carbonil i transformar les cetones en alcans. Són la reducció de Clemmensen, que fa servir un amalgama de zinc i mercuri i àcid clorhídric concentrat; i la reducció de Wolff-Kishner, que utilitza hidrazina i hidròxid de potassi dissolts en un alcohol d'alt punt d'ebullició i calor.

Reducció a alcohols[modifica]
Les cetones es poden reduir a alcohols secundaris mitjançant una àmplia diversitat d'agents reductors. Els més utilitzats en síntesi orgànica són la hidrogenació catalítica sobre un catalitzador metàl·lic, per exemple un corrent d'hidrogen sobre níquel de Raney, i la reducció amb borohidrur de sodi o amb hidrur d'alumini i liti .
Addició de reactius de Grignard i composts d'organoliti[modifica]

Les cetones es poden transformar en alcohols terciaris per addició de grups alquil emprant reactius de Grignard o composts d'organoliti .
Hidratació[modifica]

Les cetones reaccionen amb l'aigua (reacció d'hidratació), la qual pot ser catalitzada per àcids o per bases. La constant d'equilibri és desfavorable, normalment, per a la hidratació de cetones, llevat que els grups alquil i , o tots dos siguin forts donadors d'electrons.[6]
Formació de cianhidrines[modifica]

Les cetones poden sofrir addició nucleòfila d'un anió cianur formant-se una cianhidrina. Les cianhidrines són intermediaris útils en síntesi orgànica perquè el grup ciano pot ser oxidat a un grup carboxil formant així un àcid carboxílic; o reduït a obtenint-se d'aquesta manera una amina primària.[6]
Formació d'acetals[modifica]

La formació d'acetals s'aconsegueix per reacció d'una acetona amb alcohols. És una reacció catalitzada amb àcids. La constant d'equilibri és normalment favorable per als aldehids i desfavorable per a les cetones. Es formen amb facilitat acetals cíclics a partir de diols veïnals.[6]
Reacció amb amines[modifica]

El producte resultant de la reacció de les cetones amb amines primàries és una imina o base de Schiff, que contenen el grup funcional . Es forma una carbinolamina intermediària, que pateix deshidratació i forma seguidament la imina. Si la reacció de la cetona és amb una amina secundària, el producte final és una enamina. No es pot deshidratar la carbinolamina intermediària i formar una imina estable.[6]
Reacció de Wittig[modifica]

A la reacció de Wittig un ilur de fòsfor reacciona amb una cetona formant-se d'un alquè. És un mètode versàtil de reacció regioselectiva d'alquens.[6] Fou descoberta pel químic alemany Georg Wittig (1897–1987), premi Nobel de química l'any 1979.
Síntesi de cetones[modifica]
Ozonòlisi d'alquens[modifica]

L'ozonòlisi d'alquens és una reacció d'escissió d'un doble enllaç per acció de l'ozó . S'empra amb més freqüència en anàlisi estructural que en síntesi química. La pauta de la substitució al voltant d'un enllaç doble es revela identificant els compostos que contenen carbonil i formen el producte.[6]
Hidratació d'alquins[modifica]

La reacció d'hidratació d'alquins succeeix a través d'un enol intermediari, format per addició d'aigua a un triple enllaç segons la regla de Markóvnikov (l'hidrogen s'addiciona al carboni que té més hidrògens).[6]
Acilació de Friedel-Crafts de composts aromàtics[modifica]

Les cetones aromàtiques presenten un o dos anells aromàtics units al grup carbonil. La majoria de les cetones aromàtiques es preparen per acilació de Friedel-Crafts, on el benzè reacciona amb els clorurs de l'àcid en presència de clorur d'alumini. Així, el grup acil entra dins l'anell per a produir cetones aromàtiques.[6]
Oxidació d'alcohols secundaris[modifica]

Les cetones normalment se sintetitzen a partir de l'oxidació d'alcohols secundaris amb un agent oxidant com el dicromat de potassi o altres reactius fets a partir d'òxids de crom(VI), com el reactiu de Jones, una dissolució d'òxid de crom(VI) en àcid sulfúric diluït.
Aplicacions[modifica]
Perfumeria[modifica]
Algunes cetones són emprades com a solvents i com a primeres matèries en perfumeria. Són presents en els olis essencials extrets de les plantes.[11] Com exemples hom pot citar la mentona, present a l'oli del gerani; la pinocarvona i la piperitona a l'oli d'eucaliptus; la verbenona, constituent principal de l'oli de verbena, de la qual en rep el nom i també es troba a l'oli de romaní; o les ionones, presents a l'oli de rosa.[12]
D'origen animal existeixen la muscona i la civetona que són utilitzats com a fixadors, perquè eviten l'evaporació dels aromes a més de potenciar-los, per la qual cosa s'utilitza en la perfumeria.[12]
Medicina[modifica]
Un bon nombre de fàrmacs són cetones. Alguns exemples són: la metadona, un opioide que s'utilitza en el tractament de desintoxicació i manteniment de l'addicció als opioides; la tolcapona, un inhibidor de la catecol-O-metiltransferasa (COMT) utilitzada com a teràpia adjunta en el tractament simptomàtic de la malaltia de Parkinson idiopàtica; la nabumetona, emprada per tractar l'artritis i l'artritis reumatoide; l'oxibenzona i la benzofenona, agents de protecció solar que es troba en els filtres solars que absorbeix els raigs UV; la tolperisona, és un blocador neuromuscular utilitzat per alleujar l'espasticitat després d'un ictus en adults; o la pitofenona, és un medicament utilitzat en el tractament del dolor espàstic causat per rampes menstruals, el sistema digestiu i el tracte urinari.[13]
Altres usos[modifica]

La cetona més simple és l'acetona o propanona i és la de major aplicació. S'usa com a dissolvent per a laques i resines, per exemple per remoure l'esmalt d'ungles, encara que el seu major consum és en la producció de plexiglàs, es fa servir també en l'elaboració de resines epoxi i poliuretans. Altres cetones industrials són les metil etil cetones i la ciclohexanona que a més de fer servir-se com a dissolvent es fa servir en gran manera per a l'obtenció de la caprolactama, que és un monòmer en la fabricació de Niló 6 i també per a l'oxidació de l'àcid adípic que es fa servir per a fabricar Niló 66.
Les cetones terpèniques com timoquinona, carvona, pulegona, dihidrocarvona, mentona, verbenona, ocimenona, càmfora, α-tujona i piperitenona, han demostrat que tenen efectes insecticides. Des d'antic s'empra la càmfora, extreta del camforer (Cinnamomum camphora), per eliminar les arnes de la roba dins dels armaris.[5]
Referències[modifica]
- ↑ Partington, J. R.. History of Chemistry. Londres: Macmillan Education, Limited, 1964. ISBN 978-1-349-00554-3.
- ↑ «acetone | Etymology, origin and meaning of acetone by etymonline» (en anglès). [Consulta: 25 novembre 2021].
- ↑ Bussy, A. «De quelques Produits nouveaux obtenus par l'action des Alcalis sur les Corps gras à une haute température.». Annales de chimie et de physique, 1833, pàg. 398-411.
- ↑ «Llista de plantes que contenen càmfora». Pherobase.(anglès)
- ↑ 5,0 5,1 Herrera, Jimena María; Zunino, María Paula; Dambolena, Jose Sebastian; Pizzolitto, Romina Paola; Gañan, Nicolás Alberto «Terpene ketones as natural insecticides against Sitophilus zeamais» (en anglès). Industrial Crops and Products, 70, 2015-08, pàg. 435–442. DOI: 10.1016/j.indcrop.2015.03.074.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 Carey, Francis A. Química orgánica. 6a ed. México: McGraw Hill, 2006. ISBN 970-10-5610-8.
- ↑ Buckle, Jane. Basic Plant Taxonomy, Basic Essential Oil Chemistry, Extraction, Biosynthesis, and Analysis (en anglès). Elsevier, 2015, p. 37–72. DOI 10.1016/b978-0-7020-5440-2.00003-6. ISBN 978-0-7020-5440-2.
- ↑ (anglès) Shalu, Tuteja. Civettictis Civetta African Civet. Animal Diversity Web, 2000. Web. 2010
- ↑ «Carbonyl Reactivity». [Consulta: 2 gener 2022].
- ↑ 10,0 10,1 10,2 Unió Internacional de Química Pura i Aplicada. Comissió de Nomenclatura de Química Orgànica. Guia de la IUPAC per a la nomenclatura de compostos orgànics : recomanacions del 1993 (incloent-hi les revisions, tant publicades com no publicades fins ara, de l'edició del 1979 de la Nomenclature of organic chemistry), febrer del 2017. ISBN 978-84-9965-333-4.
- ↑ «Cetona». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ 12,0 12,1 «Fragrance sample? Aldehydes and ketones - ingredients». [Consulta: 3 gener 2022].
- ↑ «Ketones | DrugBank Online». [Consulta: 3 gener 2022].
Vegeu també[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Cetona |

































