Calor

La calor (de símbol Q) és una forma d'energia que es produeix amb el moviment cinètic de les molècules d'un cos o partícula.
També es pot definir com una sensació que s'experimenta en rebre directament o indirectament la radiació solar, o d'aproximació a una font exotèrmica.
En la física la calor es defineix com a l'intercanvi d'energia que es produeix a qualsevol procés en el qual el sistema no és aïllat de l'entorn i hi existeix un gradient de temperatures a les fronteres del sistema analitzat. No s'ha de confondre el concepte de calor amb el de temperatura ni tampoc amb el d'entalpia.
Introducció a la calor[modifica]

El familiar experiment d'ajuntar dos sistemes o zones que no estan en equilibri de temperatures té un resultat universalment conegut: La calor flueix entre ambdós sistemes i quan arriba a l'estat final, les temperatures dels dos seran iguals i amb un valor intermedi entre les temperatures inicial i final. El resultat és que la calor, espontàniament, flueix de les zones amb alta temperatura cap a les zones de baixa temperatura fins a arribar a l'equilibri tèrmic.
A començaments del segle xix, es defineix el concepte de calor a la disciplina de la Calorimetria. Aquesta definició podria ser útil en l'actualitat si no fos per l'atribut de substància que se li confereix al calor, que no està d'acord amb l'actual definició.[1] Aquesta disciplina tractava principalment amb l'experimentació i mesura de transferències de calor mitjançant calorímetres i s'explicava mitjançant postulats l'existència d'una substància denominada calòric a l'interior de cada cos. Segons aquesta disciplina la matèria s'aniria desplaçant de cos en cos segons la direcció decreixent del gradient de temperatures a cada punt, açò és, de les zones d'alta temperatura a les de baixa.[2] La transferència d'aquesta substància es manifestava amb l'equilibri de temperatures una vegada dos cossos es posaven en contacte, de manera que el cos que més calor contenia al seu interior li'n cedia a l'altre una quantitat determinada, de tal manera que en transcórrer un temps suficient les temperatures dels dos eren la mateixa.
Al present, l'evolució de la termodinàmica formula la definició de calor que només contempla transferències d'aquesta mena d'energia entre un sistema i el seu entorn quan existeixen diferències de temperatura entre els dos. El que realment és útil de la definició que es dona a la calorimetria és el fet del coneixement d'una transferència 'd'alguna cosa' entre un sistema i un altre. En resum, en termes energètics es podria definir la calor bescanviada com la suma de l'energia transferida.
Cal aclarir que no és el mateix calor que energia interna, ja que la calor està relacionada amb el canvi de l'energia interna i amb el treball del sistema és a dir que la calor descriu el flux d'energia i l'energia interna descriu l'energia interna en ella mateixa.
Definició de calor a termodinàmica[modifica]
Per tal de donar aquesta definició cal primer tenir present les nocions que aporten el primer principi de la termodinàmica i la definició del treball. Una vegada s'expliquen aquestes dues nocions es pot definir la calor com a intercanvi d'energia suposant condicions no adiabàtiques. La manera de definir la calor, comprèn doncs les següents consideracions:
- Nocions sobre la selecció de sistemes termodinàmics
- Estudi de sistemes adiabàtics
- Postulat de la independència del camí necessari per arribar a un mateix estat termodinàmic
- Definició de la calor en sistemes no adiabàtics

A l'hora d'analitzar els diferents casos simplificats, és necessari marcar unes fronteres al sistema del qual es fa l'anàlisi, ja que segons diferents punts de vista, les transferències amb l'exterior seran de calor, de treball o bé nul·les. Posem-ne l'exemple d'una cuina d'inducció on s'escalfa aigua emprant un recipient metàl·lic. Durant l'escalfament, el recipient serà sotmès a variacions en el camp magnètic que el travessa, generat gràcies als inductors de la cuina. Si se suposa que l'origen de l'alimentació de la cuina no té pèrdues d'energia i suposant també que els inductors de la cuina no tenen resistència al pas del corrent, si a més se suposa que les fronteres d'aquest sistema són aïllades tèrmicament, es té un dispositiu al qual l'estat termodinàmic varia només gràcies al treball magnètic[3] que s'aconsegueix amb l'electricitat que causa el camp.
Les fronteres del sistema de la cuina poden escollir-se per tal d'analitzar el problema des del punt de vista energètic. Per exemple, es podria escollir el sistema que només comprèn l'aigua continguda al recipient, corresponent la resta de l'univers a l'entorn per definició. En aquest cas, es transmet calor per les parets del sistema definit, ja que l'aigua està en contacte directe amb un recipient calent. La segona consideració podria ser la d'incloure al sistema el recipient, quedant com a entorn la resta de l'univers, d'igual manera que l'anterior exemple. En aquest cas s'està treballant sobre el sistema en comptes d'haver-hi una transmissió de calor efectiva entre les fronteres d'aquest. És la variació forçada del camp magnètic al qual se sotmet el recipient metàl·lic el que fa que aquest material ferromagnètic tinga variacions internes al seu camp, aleshores el treball magnètic és l'única interacció que es podria considerar entre el sistema aigua+recipient i el seu entorn (la cuina i la resta de l'univers). Es podria establir un símil amb un sistema d'escalfament d'aigua amb resistència elèctrica o bé amb una modificació del mateix aparell de Joule, amb les que estudiar l'impacte de la selecció de sistemes en la transmissió d'energia estudiada.[2]
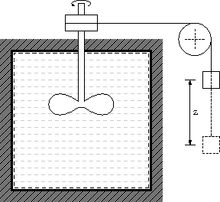
Un procés s'anomena adiabàtic si les interaccions entre sistema i ambient són únicament treballs exercits per un sistema sobre l'altre. D'aquesta manera, se suposa idealment que les fronteres que separen el sistema analitzat i el seu entorn són totalment aïllades i no es poden apreciar les possibles diferències de temperatures a un costat i l'altre. L'anterior sistema de la cuina d'inducció era un exemple de procés adiabàtic si es considerava com a sistema l'aigua juntament amb el recipient. Altres exemples són el de l'aparell de Joule i el d'una resistència escalfant un recipient amb aigua considerant el treball que li subministraria una font d'alimentació.
Si es considera cada exemple de procés adiabàtic exposat anteriorment es podria aplicar cada mètode a les mateixes quantitats d'aigua en els mateixos recipients, considerant també l'aïllament tèrmic de les fronteres i partint de les mateixes condicions inicials. Fent aquesta mena d'experiments s'ha demostrat que en introduir treballs iguals a un sistema, es produeixen canvis iguals en el seu estat termodinàmic, ja siga fent-ho per mitjà de diferents processos adiabàtics o bé gràcies a la combinació d'aquestos. D'aquesta manera, s'arriba a la definició de la primera llei de la termodinàmica:
Quan un sistema tancat s'altera adiabàticament, el treball net associat amb el canvi d'estat és el mateix per a tots els processos possibles entre dos estats d'equilibri donats[4]
Que és l'expressió del postulat formulat gràcies als treballs experimentals començats per Joule a mitjans del segle xix.
Amb aquesta definició s'ha vist la correlació unívoca entre les diferents maneres de realitzar un treball i un canvi en l'estat termodinàmic del sistema. Això vol dir que el canvi d'estat no depèn de la trajectòria o la manera en la qual es realitze el procés adiabàtic, només depèn del treball aportat. Aquesta apreciació és interessant des del punt de vista de tractament de l'energia interna d'un sistema, que es pot definir com a variable d'estat, ja que en aquest cas només dependria d'una quantitat d'energia en forma de treball (més endavant es veurà també en forma de calor) que es transmet. A més, aquesta definició és coherent amb la de funció o variable d'estat:
El valor d'una funció d'estat només depèn de l'estat termodinàmic actual que es trobi el sistema sense importar com va arribar a ell
L'energia interna E d'un sistema es defineix com a magnitud fixada pel treball adiabàtic i només dependent dels estats final i inicial del procés. De fet si es considera la variable del canvi d'energies com a diferència entre dos valors d'aquesta propietat (un inicial i un altre final) es té la següent definició d'acord amb la primera llei:
- .
On E són les energies internes i W és el treball adiabàtic introduït al sistema per qualsevol mitjà.
El resultat d'aquestes observacions és necessari per avançar en una formulació de la primera llei que s'aplique de manera general a sistemes tancats no necessàriament adiabàtics. Aquestos sistemes són més habituals al laboratori i a la vida real, només cal imaginar una cuina de gas o una màquina de vapor, per fer-se la idea de l'existència de processos on les diferències tèrmiques entre un sistema i el seu entorn té un pes semblant o major que treball mecànic a l'hora de variar el que s'ha definit com a energia interna.
L'experimentació en sistemes tancats no adiabàtics ha portat a demostrar que es pot aconseguir el mateix canvi d'estat termodinàmic amb una màquina de Joule que mitjançant l'aplicació exclusiva de diferències de temperatura entre sistema i entorn, cosa que porta a definir el que s'anomena transferència de calor i també es reformula la primera llei:[5][4]
La calor i el treball són els únics mecanismes mitjançant els quals podem transferir energia a través de les fronteres d'un sistema tancat
D'igual manera que s'ha fet amb els processos adiabàtics per la definició de l'energia interna, si a un sistema no adiabàtic se li aplica un treball i l'estat termodinàmic canvia d'una situació inicial i a una final f, se sap que el treball no correspon exactament a l'energia interna, ja que s'hauran produït transferències de calor entre sistema i entorn, per això es defineix calor Q transferit com:
De manera que Q és la diferència entre la variació d'energia interna i el treball que s'ha realitzat sobre el sistema tancat.[4]
Aquesta última equació conté tres idees necessàries a les que s'arriba a l'hora de definir la calor:[2]
- El concepte de l'energia interna com a funció d'estat
- Principi de conservació de l'energia (experimental)
- Definició de la calor com a energia igual que ho és el treball
La traducció d'aquesta fórmula a la manera diferencial seria:
On s'ha d'observar que la notació diferencial exacta només aplica a l'energia interna, ja que és l'única funció d'estat, mentre que les altres dos magnituds, calor i treball són en efecte diferencials que depenen del recorregut o camí que se segueix per tal d'integrar-les.
Transmissió de calor[modifica]

La taxa de transferència de calor, o flux de calor per unitat de temps té aquesta notació que es mesura en wats:
- .
La calor pot ser transferida entre dos cossos per tres mecanismes diferents:
Capacitat calorífica[modifica]
La capacitat de calor es defineix com la quantitat de calor que pot ser transferida des de o a un objecte quan la seva temperatura varia en un grau. És una característica específica de cada cos o substància i s'anomena calor específica quan es refereix a una unitat de quantitat com de la massa o el Mol.
La calor latent es defineix com la quantitat de calor bescanviat durant un canvi de fase (de líquid a sòlid, de líquid a gas, etc.) aquesta calor bescanviada depèn principalment del tipus de substància i de la fase inicial i final.
Segons la primera llei de la termodinàmica, la calor (i el treball) són processos que canvien l'energia interna d'un objecte o una substància. La calor és la transferència d'energia amb un gradient de temperatura.
Unitats de mesura de calor o energia[modifica]
La calor té dimensions d'energia i la unitat del SI per la calor és el joule (símbol: J). Als Estats Units de vegades encara s'utilitza el peu lliura-força (ft·lbf) o BTU British Thermal Unit al sistema USCS.
Tradicionalment la quantitat de calor es mesura encara en quilocalories que és la quantitat de calor que s'ha de subministrar a un quilogram d'aigua per elevar la seva temperatura un grau Celsius.
Una caloria és la quantitat de calor que s'ha de subministrar a un gram d'aigua per tal d'elevar la seva temperatura un grau Celsius.
- 1 joule = 0,24 calories
- 1 caloria-quilogram = 1000 calories-gram
Història[modifica]

La comprensió que la calor és energia ha portat molts anys d'investigació i d'experiments.
Heràclit va ser el primer a elaborar una teoria de la calor amb la seva idea filosòfica sobre que tot fluïa i que tot era un bescanvi del foc.
Francis Bacon i Robert Hooke van recuperar, al segle xvii, la noció de calor com a moviment.
El 1761, Joseph Black va descobrir el fet de la calor latent. James Watt, inventor d'una màquina de vapor de gran èxit, va ser el seu deixeble.
Johann Becher va proposar la teoria del calòric associada a un material indetectable anomenat flogist. Aquesta teoria, durant llarg temps, va ser refutada pels experiments d'Antoine Lavoisier cap a 1783.
El 1695, les observacions del físic francès Denis Papin a les vàlvules de les cuines de pressió fan que es plantege la idea de motors de vapor de pistó i cilindre, suposant que la calor es pot transformar en treball mecànic.[6]
El 1798, el Benjamin Thompson, el comte de Rumford va observar l'elevació de temperatura a la llimalla dels canons perforats i va deduir que la causa de l'elevació de temperatura era el treball mecànic efectuat al fer els forats. Aquestos experiments van portar a les primeres evidències que no s'estava tractant amb substància, perquè existia una relació entre el treball efectuat i l'augment de temperatura.[7] Un any més tard, Sir Humphry Davy va intentar demostrar que dos trossos de gel podien fondre's per refregament, per tal de demostrar que la calor és una altra forma d'energia, però el seu experiment fou poc decisiu.[2]
El 1824 Sadi Carnot publicà Reflexions sobre l'energia del foc on establí uns dels principis de la termodinàmica moderna.
La idea que la calor és una forma d'energia que es pot transformar en treball i que aquest es pot transformar en calor, fou rellançada el 1839 per un enginyer francès, Marc Séguin, el 1842 per Robert Mayer, un metge alemany, per Ludwig Colding el 1843, per Carl Holtzmann el 1845 i per Gustave-Adolphe Hirn el 1850.[8] Tot i això, encara i comptant amb aquestos treballs, fou decisiva la important tasca de James Prescott Joule que va establir que el treball podia convertir-se en calor determinant que simplement era un canvi en la forma de l'energia. Aquest investigador es va basar en els experiments que va realitzar de 1840 a 1849 al seu laboratori privat. Fou gràcies a aquestes experiències que es va convèncer el món de les relacions entre calor i treball, per tal d'establir l'equivalència entre calor i treball.[2] L'experiment de la roda de pales de 1843 és el més conegut com a unificador entre la naturalesa del treball i la calor. En aquest experiment es penja un pes amb un fil enrotllat a l'eix d'una roda de fusta. Aquesta connexió fa que la roda gire en descendir el pes, de manera que amb la rotació de les pales s'agita un recipient amb aigua i com a resultat, la temperatura augmenta.
El 1847 ja es reconeixia el treball de Joule per part de Hermann von Helmholtz, que va aplicar les idees de Joule a la fisicoquímica i la fisiologia.[9]
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Calor |
- Plasma heat at 2 gigakelvins - Article about extremely high temperature generated by scientists (Foxnews.com)
- Heat and Thermodynamics - Georgia State University
- Correlations for Convective Heat Transfer - ChE Online Resources
Referències[modifica]
- ↑ Thompson, William. On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule’s equivalent of a Thermal Unit, and M. Regnault’s Observations on Steam (en anglès).
- ↑ 2,0 2,1 2,2 2,3 2,4 Zemansky, Mark. W.. Mc-Graw Hill. Calor i termodinàmica (en castellà (1984) i anglès (1981)), 1981. ISBN 0-07-072808-9.
- ↑ Valentí, Ros er. «3. Work, heat and the first law of thermodynamics». A: Institut fur Theoretische Physik Universitat Frankfurt. Thermodynamics and statistical physics [Consulta: 28 juny 2009]. Arxivat 2010-10-11 a Wayback Machine.
- ↑ 4,0 4,1 4,2 Wark, Keneth; Richards, Donald E. Termodinámica (en castellà), 2001.
- ↑ Gupta, M. C.. New Age International. Statistical Thermodynamics, 1998. ISBN 8122410669.
- ↑ Tredgold, Thomas. The steam engine: comprising an account of its invention and progressive improvement (en anglès). J. Taylor, 1827, p.6.
- ↑ Thomson, Benjamin. Philosophical Transactions. Vol. XVIII, pg. 286.. An Inquiry Concerning the Source of Heat which is Excited by Friction, 1798.
- ↑ McCulloch, Richard S. Treatise on the Mechanical Theory of Heat - and its applications to the Steam-Engine, etc. (en anglès). Nova York: D. Van Nostrand Publishers, 1876.
- ↑ Cahan, David. University of California Press. Hermann von Helmholtz and the foundations of nineteenth-century science (en anglès), 1993. ISBN 0520083342.




