Heparan sulfat
| Substància química | polímer, classes de components químics amb similar orígen o font i classe estructural d'entitats químiques |
|---|
L'heparan sulfat (HS) és un polisacàrid lineal que es troba a tots els teixits animals. Es troba en forma de proteoglicà on dues o tres cadenes d'heparan sulfat estan lligades molt properes a la membrana cel·lular o a proteïnes de la matriu extracel·lular.[1][2] En aquesta forma l'heparan sulfat s'acobla a un gran ventall de lligands proteics i regula una àmplia varietat d'activitats biològiques, com per exemple processos de desenvolupament, angiogènesi, coagulació sanguínia i metàstasi tumoral.
Proteoglicans[modifica]
La major part de proteoglicans d'heparan sulfat són els sindecans transmembrana i la proteïna GPI (glicofosfatidilinositol) ancorada en els glipicans. Altres formes menys corrents de proteoglicans d'heparan sulfat són els betaglicans[3] i la isoforma V-3 del CD44, present en els queratinòcits i els monòcits[4] activats. A la matriu extracel·lular, especialment a la membrana basal, la proteïna multifuncional perlecan, l'agrina i el col·lagen XVIII són les principals proteïnes que porten heparan sulfat.
L'estructura de l'heparan sulfat i diferències respecte a l'heparina[modifica]
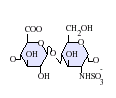
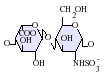
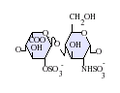
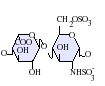
L'heparan sulfat pertany a la família dels glicosaminoglicans (GAGs), uns tipus d'hidrats de carboni. La seva estructura és molt semblant a la de l'heparina; ambdues estan constituïdes per unitats repetitives de disacàrids sulfatats de diverses maneres. Les principals unitats de disacàrid que constitueixen l'heparan sulfat i l'heparina es mostren a continuació.
El disacàrid més comú en l'heparan sulfat està constituït per àcid glucorònic (GlcA) lligat a N-acetilglucosamina (GlcNAc), els quals comprenen al voltant del 50% del total d'unitats de disacàrids. En l'heparina, en canvi, l'IdoA(2S)-GlcNS(6S) conforma la majoria de molècules d'heparina. Per exemple, en el pulmó de bou representa el 85% de i sobre un 75% de les que es troben a la mucosa intestinal del porc. Ara bé, tot es complica quan hem de definir els glicosaminoglicans híbrids que contenen estructures semblants a l'heparina i a l'heparan sulfat. S'ha suggerit que un glicosaminoglicà només s'hauria de considerar com a heparina si el seu contingut de grups de N-sulfat superessin amb escreix el nombre dels grups de N-acetil, i la concentració de grups O-sulfat excedís en gran nombre els grups de N-sulfat.[5] En resum, un GAG es consideraria heparina si el nombre de grups d'O-sulfat fos més gran que els de N-sulfat, i aquests, al seu torn, als de N-acetil.
-
GlcA-GlcNAc -
GlcA-GlcNS -
IdoA-GlcNS -
IdoA(2S)-GlcNS -
IdoA-GlcNS(6S) -
IdoA(2S)-GlcNS(6S)
Abreviacions[modifica]
- GlcA = β-L-àcid glucorònic
- IdoA = α-L-àcid idurònic
- IdoA(2S) = 2-O-sulfo-α-L-àcid idurònic
- GlcNAc = 2-desoxi-2-acetamido-α-D-glucopiranosil
- GlcNS = 2-desoxi-2-sulfamido-α-D-glucopiranosil
- GlcNS(6S) = 2-desoxi-2-sulfamido-α-D-glucopiranosil-6-O-sulfat
Biosíntesi de l'heparan sulfat[modifica]
S'ha comprovat que existeix una gran variabilitat pel que fa a les vies de síntesi d'heparan sulfat. A més, s'ha vist que molts tipus de cèl·lules produeixen cadenes d'HS amb diferents estructures primàries. Tanmateix, existeix una gamma d'enzims que són indispensables, independentment de la variabilitat de l'estructura primària. Aquests enzims consisteixen en una sèrie de glicosiltransferases, sulfotransferases i una epimerasa. A més, també s'encarreguen de la síntesi l'heparina.
Molts d'aquests enzims han estat recentment purificats, clonats molecularment i s'han estudiat els seus patrons d'expressió. A partir d'aquests experiments, i també treballs anteriors on s'estudiaven els passos fonamentals en la síntesi d'heparan sulfat i heparina a partir d'un mastocitoma de ratolí, s'ha obtingut molta informació sobre l'ordre de les reaccions enzimàtiques i la seva especificitat.[6]
Inici de la cadena[modifica]
La síntesi d'heparan sulfat s'inicia amb la transferència d'una xilosa des d'una UDP-xilosa (per part de la xilosiltranferasa) cap a un residu específic de serina que forma part d'un nucli proteic. La unió de dos residus de galactosa (per la galactosiltransferasa I i II) i d'àcid glucorònic (per part de la glucoronosiltransferasa I) completa la formació d'un tetrasacàrid que s'uneix al nucli proteic.
Es creu que la unió de la xilosa al nucli proteic succeeix al reticle endoplasmàtic, i que tota la resta del tetrasacàrid i la part restant de la proteïna s'hi uneixen a l'aparell de Golgi.
Els camins de la biosíntesi de l'heparan sulfat divergeixen dels del condroitin sulfat (CS) i el dermatan sulfat (DS), dos glicosaminoglicans molt semblants, després de la formació de l'estructura vinculant comuna. Depenent de l'enzim que actuï a continuació obtindrem HS o bé CS/DS.
Prolongació de la cadena[modifica]

Després de la unió del primer residu de N-acetilglucosamina (GlcNAc), la prolongació del tetrasacàrid vinculant continua amb l'addició de residus de GlcA i GlcNAc. Aquests són transferits des dels seus respectius nucleòtids d'UDP. Això és dut a terme per diversos enzims els gens dels quals formen part de la família de les exoestoses (EXT), que són supressores tumorals.
Mutacions en el loci del gen humà EXT1-3 duu cap a una inhabilitat per part de les cèl·lules per produir HS, fet que porta al desenvolupament de la malaltia hereditària exostosi múltiple (MHE).
La MHE es caracteritza per la presència de tumors de cobertes de cartílag, coneguts com a osteocondromes o exostoses, que es desenvolupen en primer lloc als ossos llargs dels individus afectats, des de la infància fins a la pubertat. Encara que les exostoses són benignes, pot ser necessària una intervenció quirúrgica per alleujar possibles efectes secundaris com ara el dolor articular i restricció del moviment.
Modificació de la cadena[modifica]
A mesura que la cadena es va polimeritzant pateix una sèrie de modificacions portades a terme per quatre tipus de sulfotransferases i una epimerasa. La disponibilitat del donador de sulfat PAPS és crucial per a l'activitat de les sulfotransferases.[7][8]
N-deacetilació/N-sulfatació[modifica]

La primera polimerització és la N-deacetilació/N-sulfatació dels residus de GlcNAc per donar GlcNS. Aquest pas és un requisit per totes les modificacions següents i és duta a terme per un o més membres de la família dels enzims GlcNAc N-deacetilasa/N-sulfotransferasa (NDSTs). En estudis anteriors es va demostrar que aquests enzims poden reconèixer i actuar en qualsevol residu N-acetilat del polímer.[9] A més a més, la modificació de residus de GlcNAc succeeixen aleatòriament al llarg de la cadena. Això no obstant, els residus N-sulfatats de l'HS estan agrupats en zones concretes i separats entre ells per regions de N-acetilació on el GlcNAc roman inalterat.
Epimerització i 2-O-sulfatació[modifica]
La reacció és catalitzada per un enzim, la GlcA C5 epimerasa, la qual epimeritza GlcA per formar àcid idurònic (IdoA). El reconeixement del substrat requereix que el residu de GlcN lligat a la part no reductora d'un objectiu potencial de GlcA sigui sulfatat. L'uronosil-2-O-sulfotransferasa (2OST) sulfata els residus resultants d'IdoA.
6-O-sulfatació[modifica]
Tres glucosaminil 6-O-transferases (6OSTs) s'han identificat com el resultat de la formació de GlcNS (6S) adjacents a IdoA sulfatat i no-sulfatat. El GlcNAc (6S) es troba també en cadenes madures d'HS.
3-O-sulfatació[modifica]
Com a mínim cinc glucosaminil 3-O-sulfotransferases (3OSTs) són el resultat de la formació del poc comú monosacàrid GlcNS (3S, 6S).
Unió al lligand[modifica]
Interferó- γ[modifica]

La regió d'unió de l'interferó-γ del receptor que es troba a la superfície cel·lular se superposa amb la regió d'unió de l'heparan sulfat, a prop de la regió carboxiterminal de la proteïna. La unió d'HS bloqueja la zona d'unió del receptor i, com a resultat, els complexos proteics d'HS estan inactius.
Moltes altres proteïnes d'unió a l'heparan sulfat estan essent estudiades:
- Factos de creixement de fibroblasts
- Antritrombina III
- Factors de creixement dels hepatòcits
- Interleucina-8
- Factor de creixement de l'endotel·li vascular
- Endostatina
Referències[modifica]
- ↑ Gallagher, J.T., Lyon, M.. «Molecular structure of Heparan Sulfate and interactions with growth factors and morphogens». A: Iozzo, M, V.. Proteoglycans: structure, biology and molecular interactions. Marcel Dekker Inc. New York, New York, 2000, p. 27–59.
- ↑ Iozzo, R. V. «Matrix proteoglycans: from molecular design to cellular function». Annu. Rev. Biochem., 67, 1998, pàg. 609–652. DOI: 10.1146/annurev.biochem.67.1.609. PMID: 9759499.
- ↑ Andres, J. L. et al. «Binding of two growth factor families to separate domains of the proteoglycan betaglycan». J. Biol. Chem., 267, 1992, pàg. 5927–5930. PMID: 1556106.
- ↑ Jackson, D. G. et al. «Proteoglycan forms of lymphocyte homing receptor CD44 are alternatively spliced variants containing the V-3 exon». J. Cell. Biol, 128, 1995, pàg. 673–685. DOI: 10.1083/jcb.128.4.673. PMID: 7532175.
- ↑ Gallagher, J. T. Walker, A. «Molecular distinctions between Heparan Sulphate and Heparin: Analysis of sulphation patterns indicates Heparan Sulphate and Heparin are separate families of N-sulphated polysaccharides». Biochem. J., 230, 1985, pàg. 665–674. PMID: 2933029.
- ↑ Lindahl, U. et al. «Regulated diversity of Heparan Sulfate». J. Biol. Chem., 273, 1998, pàg. 24979–24982. DOI: 10.1074/jbc.273.39.24979. PMID: 9737951.
- ↑ Silbert, J. E. «Formation of a sulfate glycosaminoglycan with a microsomal preparation from mast cells». J. Biol. Chem., 242, 21, 10-11-1967, pàg. 5146–5152. Arxivat de l'original el 21 de juny 2008. PMID: 4228675 [Consulta: 10 desembre 2009].
- ↑ Carlsson P, Presto J. et al. «Heparin/Heparan Sulfate Biosynthesis: Processive formation of N-sulfated domains». J. Biol. Chem., 283, 29, 2008, pàg. 20008–20019. DOI: 10.1074/jbc.M801652200. PMID: 18487608.
- ↑ Höök, M. et al. «Biosynthesis of heparin. Studies on the microsomal sulfation process». J. Biol. Chem., 250, 1975, pàg. 6065–6071. PMID: 807579.