Immunocromatografia
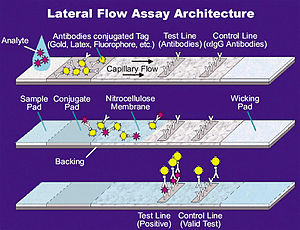
La immunocromatografia és una de les tècniques d'immunodiagnòstic més modernes i les seves principals avantatges són la simplicitat i la rapidesa de la prova (qüestió de minuts). Cada vegada són més les aplicacions d'aquesta tècnica, tant en l'àmbit dels testos, ja que no calen reactius ni instrumentació addicional, com en el camp clínic. L'exemple més conegut són els test d'embaràs de les farmàcies, psa, test de troponina I, i recentment, test sobre el VIH. Es pot realitzar mitjançant un dispositiu simple portat a terme per detectar la presència (o absència) d'un compost objectiu a la mostra (la matriu). Aquest tipus de proves són emprades comunament per al diagnòstic mèdic ja sigui per a realitzar proves a casa, o al laboratori. Es presenta en un format de tira, en el qual la mostra problema flueix per un substrat sòlid mitjançant acció capil·lar.
Funcionament[modifica]
La immunocromatografia es basa en la migració d'una mostra a través d'una membrana de nitrocel·lulosa. La mostra és afegida en la zona del conjugat, el qual està format per un anticòs específic contra un dels epítops de l'antigen a detectar, i un reactiu de detecció (metall pesant o micro-esferes de làtex) unit a l'anticòs. Si la mostra conté l'antigen problema, aquest s'unirà a l'anticòs conjugat formant un complex immune i migrarà a través de la membrana de nitrocelulosa. Sinó, migraran el conjugat i la mostra sense unir-se.
La zona de captura està formada per un segon anticòs específic contra un altre epítop de l'antigen. A l'arribar la mostra a aquesta zona, els complexos formats per la unió de l'antigen i el conjugat quedaran retinguts i la línia s'acolorirà (mostres positives). En cas que no canviï el color de la banda seran mostres negatives.
La zona control està formada per un tercer anticòs que reconeix el l'anticòs específic de l'antigen, unit al reactiu de detecció. Quan la resta de mostra arriba a aquesta zona, l'anti-anticòs s'unirà al conjugat lliure que no ha quedat retingut a la zona de captura. Aquesta línia és un control que l'assaig ha funcionat bé, ja que s'acoloreix sempre, amb mostres positives i negatives.
Interpretació[modifica]

positiva si les dues bandes canvien de color,
negativa si la banda de més a prop d'on es posa la mostra no canvia de color i
errònia tant si cap banda canvia de color o només ho fa la més propera (símptoma que la mostra no ha arribat a les dues bandes)
Mostra positiva: Observem dues marques de color en la membrana, una corresponent al complex d'antigen amb l'anticòs marcat amb el reactiu (línia de test) i l'altre la interpretem com a l'anticòs lliure que no s'ha unit a l'antigen problema (línia de control).[1]
Mostra negativa: Només observem una marca de color que correspon als anticossos lliures marcats amb el reactiu. És important que aquesta ratlla estigui en el lloc corresponent de la membrana, és a dir, a la línia de control.
Si la marca d'anticossos lliures està en el lloc on ens hauríem de trobar la del complex antigen-anticòs (línia de test), acceptarem que hem realitzat malament el test i el tornarem a fer, en el cas que no ens aparegui cap marca també haurem de repetir la prova.
Tipus[modifica]
Hi ha dos tipus principals d'immunocromatografia o immunoassaig de flux lateral, en microbiologia:[2]
Assajos de sandvitx d'anticossos doble[modifica]
- Funcionament: En aquest format, la mostra migra des del coixinet o zona de mostra a través del coixinet del conjugat on qualsevol anàlit objectiu present s'unirà al conjugat. La mostra continua migrant a través de la membrana fins que arriba a la zona de captura on el complex diana / conjugat s'unirà als anticossos immobilitzats que produeixen una línia visible a la membrana. La mostra després migra encara més al llarg de la tira fins que arriba a la zona de control, on l'excés de conjugat s'unirà i produirà una segona línia visible a la membrana. Aquesta línia de control indica que la mostra ha emigrat a través de la membrana com es pretén.
- Interpretació: Dues línies clares sobre la membrana és un resultat positiu. Una sola línia a la zona de control és un resultat negatiu.
- Aplicacions: Doble assajos de sandvitx d'anticossos són els més adequats per a grans anàlits, com ara patògens bacterians i virus, amb múltiples llocs antigènics.
Assajos de competitivitat[modifica]
- Funcionament: Els assajos competitius s'utilitzen principalment per provar molècules petites i diferir del format sandvitx de doble anticòs en el coixinet de conjugat que conté anticossos que ja estan enllaçats amb l'anàlit diana, o a un anàleg del mateix. Si l'anàlit diana és present a la mostra, no s'unirà amb el conjugat i romandrà sense marcar. A mesura que la mostra migra al llarg de la membrana i arriba a la zona de captura, un excés d'anàlit no marcat s'unirà als anticossos immobilitzats i bloquejarà la captura del conjugat, de manera que no es produirà cap línia visible. El conjugat no unit s'unirà als anticossos a la zona de control produint una línia de control visible.
- Interpretació: Una línia regulable sobre la membrana és un resultat positiu. Dues línies visibles en les zones de captura i control és un resultat negatiu. No obstant això, si un excés d'anàlit objectiu no marcat no és present, una línia feble pot ser produïda a la zona de captura, el que indica un resultat no concloent.
- Aplicacions: Els assaigs competitius són els més adequats per a l'assaig de molècules petites, com ara les micotoxines, incapaces d'unir-se a més d'un anticòs a la vegada. Hi ha un nombre de variacions en la tecnologia de flux lateral. La zona de captura a la membrana pot contenir antígens immobilitzats o enzims, depenent de l'anàlit diana, en lloc d'anticossos. També és possible aplicar diverses zones de captura per crear un assaig múltiple. Per exemple, s'han desenvolupat tires d'assaig comercials capaces de detectar tant EHEC Shiga toxines ST1 i ST2 per separat a la mateixa mostra.
Origen i actualitat[modifica]
La tecnologia bàsica que subjau en immunoassajos de flux lateral es va descriure per primera vegada en la dècada de 1960, però la primera aplicació comercial va ser Clearview Unipath la prova d'embaràs casolana llançada el 1988. Des de llavors, la mateixa tecnologia que s'ha emprat per desenvolupar una àmplia i sempre creixent de proves per a la clínica, la indústria veterinària, agricultura, menjar, bio-defensa i aplicacions ambientals.[2]
Els tests d'immunocromatografia que s'han desenvolupat i investigat els darrers anys serveixen per a la detecció d'antígens i anticossos. Actualment hi ha un projecte finançat per la Comunitat Europea en el qual el Statens Serum Institute (Copenhaguen) i altres centres d'investigació de fora de la Comunitat elaboren un test immunocromatogràfic per la detecció de la tuberculosis en sèrum, plasma i sang.[3]
Proves quantitatives[modifica]
Mentre que la majoria dels immunoassajos de flux lateral són només capaços de proporcionar un resultat qualitatiu, és possible obtenir un cert grau de quantificació mitjançant el mesurament de la quantitat de conjugat unit a la zona de captura. Això es pot fer usant un lector dedicat per mesurar la intensitat de la línia de prova de color. Per exemple, la Corporació Neogen ha desenvolupat el lector de flux Accuscan ™ lateral per a ús amb la seva gamma de Reveal ® i kits d'assaig Charm Sciences també proporciona un lector per Rosa ® rang de tires de prova de micotoxines. Tècniques més sofisticades, com ara fluorescents conjugats colorant marcats, també s'han desenvolupat per millorar el potencial quantitatiu d'assaigs de flux lateral.[2]
Estudis relacionats[modifica]
Seguidament es citen alguns estudis més o menys actuals en els quals aquesta tècnica ha estat important per al seu diagnòstic degut a les característiques que presenta, anteriorment explicades.
Diagnòstic de la infecció per Taenia solium[modifica]
- Objectiu: Avaluar la tècnica d'immunocromatografia pel diagnòstic de la infecció per Taenia solium en hàmsters mitjançant caproantígens.[4]
- Materials i mètodes: Es va produir en Oryctolagus cuniculus (conill) IgG anti-antigens d'excreció/secreció (ES) de T.solium i en Capra hircus (cabra) IgG anti-IgG de conill. Part de les IgG anti-antígens ES de T.solium va ser conjugada amb or col·loidal. La immunocromatografia es va dur a terme utilitzant tires de nitrocelulosa en les quals es fa fixar dues bandes amb anticossos de captura; en la primera, les IgG anti-antigens ES de T.solium (banda de prova) i en la segona, les IgG anti-IgG de conill (banda control). La tècnica va ser avaluada amb un "pool" de 3 mostres de medi de cultiu amb antigens ES de T.solium, Hymenolepsis nana, Dyphillobotrium pacificum i de larves d'Anisakis simplex, així com un "pool" de 3 mostres fecals de hàmsters no parasitats, de parasitats per Hymenolepsis nana i de set mostres fecals de hàmsters parasitats per T.solium.
- Resultats: La immunocromatografia va permetre detecar antígens de T.solium en mostres de medi de cultiu amb Ags ES específiques i en femtes de hàmsters parasitats per T.solium mitjançant la coloració de la banda de prova, sent negatiu quan es va utilitzar medis amb ES d'altres helmints i sense antígens, així com amb mostres de femtes de hàmsters infectats per altres paràsits i de no parasitats. En totes les tires utilitzades, es va observar la coloració de la banda control.
- Conclusió: La tècnica d'immunocromatografia és capaç de detectar antígens de T.solium, tant en medi de cultiu com en femtes de hàmsters.
Detecció de P. falciparum[modifica]
La immunocromatografia és útil també a la detecció de la forma asexual del virus de la malària in vivo, amb resultats amb elevada especificitat i sensibilitat (lleugerament més baixa, ja que no es detecten els gametòcits madurs de Plasmodium falciparum), com ve demostrat per un estudi fet amb “dipstick kits”. El fet que la sensibilitat d'aquest test sigui més baixa no influeix negativament a la validesa del test. No obstant, als països endèmics d'aquest parasita, els kits són molt cars. Segueixen sent útils aquests tests per la infecció per falciparum en casos on els centres d'investigació no tinguin microscopis d'examinació disponibles per a un diagnòstic a temps.[5][6]
Altres àrees d'investigació[modifica]
Els tests immunocromatogràfics poden ser útils també en altres àrees que no pas la medicina. En l'àmbit alimentari, permeten la detecció de l'aflatoxina B1, millorant la seguretat alimentària, ja que les aflatoxines són tòxiques. Hi ha altres tècniques per la detecció d'aquestes aflatoxines, el que passa és que són més cares i triguen més temps. Aquest assaig accelera així el diagnòstic analític i és una via alternativa per realitzar un test sense utilització de reactius, permetent un únic procediment. Donada la seva senzillesa, aquests tests es poden dur a terme en el lloc on es recull l'espècimen.[7]
Especialitats diagnòstiques[modifica]
Ingezim PARVO-CROM (15.CPV.K.4)[modifica]
Introducció: Ingezim PARVO-CROm és un assaig immunocromatogràfic directe, basat en una tècnica de migració que utilitza anticossos monoclonals (AcMs) específics enfront a les proteïnes VP1 i VP2 del Parvovirus Caní (CPV).
Bases tècniques del producte: el dispositiu de diagnòstic està compost per una placa de plàstic amb dues finestres:
- a)Finestra d'addició de la mostra: conté una mescla de AcM específics enfront a les proteïnes VP1 i VP2 de CPV i una proteïna control, units a partícules de làtex colorejat.
- b)Finestra de lectura de resultats: conté una línia test (T) formada per AcM específics de Parvovirus Caní i una línia control (C) formada per un AcM específic de la proteïna control.
Aplicacions: el producte ha sigut dissenyat per la detecció de les proteïnes VP1 i VP2 de Parvovirus Caní tipus 2, 2a i 2b i en mostresbiològiques de gossos (femtes): així com per la detecció del Virus de la Panleucopenia Felina en mostres biològiques de gats (femtes).
Procediment: afegir la dil·lució de la mostra a la finestra circular. Si la mostra conté les proteïnes VP1 o VP2 de CPV, AcM que es troben conjugats al làtex (AcM-làtex) s'uniran a elles i migraran per la membrana. El compelx Ag-làtex-AcM s'unirà als AcM situats a la zona test (T) donant lloc a l'aparició d'una línia vermella/rosa. L'aparició d'una línia blava en la zona control (C) indica que l'assaig és vàlid.
Interpretació dels resultats:
- a)Mostra positiva: línia vermella/rosa a la zona test (T) i línia blava a la zona control (C)
- b)Mostra negativa: únicament una línia blava a la zona control (C)
- c)Assaig no vàlid sense línia blava a la zona control (C)[8]
Notes i referències[modifica]
- ↑ «Reactiu per a anàlisi d'aliments. NH IMMUNOCHROMATO O26» (en anglès). Cosmo Bio Co., LTD,. Arxivat de l'original el 2013-05-15. [Consulta: 4 gener 2013].
- ↑ 2,0 2,1 2,2 http://www.rapidmicrobiology.com/test-methods/Lateral-flow-assay.php Arxivat 2013-01-20 a Wayback Machine., www.rapidmicrobiology.com, Consulta: 09/01/2013
- ↑ «Fabricantes de kits para diagnostico de enfermedades infecciosas» (en castellà). Vircell. [Consulta: 7 gener 2013].
- ↑ http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-46342001000200002, Revista Peruana de Medicina Experimental y Salud Publica, Consulta: 05/01/2013
- ↑ http://www.ams.ac.ir/AIM/0141/edrissian0141.html Arxivat 2012-12-31 a Wayback Machine., ICT Malaria Pf, Consulta: 07/01/2013
- ↑ http://www.ajol.info/index.php/ajcem/article/view/7385/13763, African Jounal Online, Consulta: 12/01/2013
- ↑ http://www.sciencedirect.com/science/article/pii/S0956713504002439, ScienceDirect pàgina web amb publicacions periòdiques d'articles científics, Consulta: 07/01/2013
- ↑ http://www.ingenasa.eu/a_prod_farm_02_tec.asp?Vtec=04 Arxivat 2012-06-21 a Wayback Machine., INGENASA, Consulta: 05/01/2013)
