Estabilitat del nucli atòmic
|
|
Aquest article o secció no cita les fonts o necessita més referències per a la seva verificabilitat. |
L'estabilitat d'un nucli atòmic és la tendència que aquest té a romandre sencer, sense "trencar-se", és a dir, la tendència que l'energia d'enllaç dels nucleons (neutrons i protons) que formen el nucli atòmic sigui prou estable perquè no produeixi la separació d'aquests (fissió nuclear).[1] En el cas de núclids d'elements químics petits, l'estabilitat del seu nucli es relaciona més aviat amb la tendència d'aquest a no "enganxar-se" a altres nucleons o nuclis formant un nucli nou (fusió nuclear).

Hi ha nuclis més estables i altres més inestables però tots tendeixen a l'estabilitat. Els molt estables es denominen núclids màgics i els inestables són radioactius, i més radioactius com més inestabilitat presentin. Aquestes característiques depenen únicament del nombre de protons i del nombre de neutrons que tingui cada nucli, i per tant del seu nombre atòmic (nombre de protons) i del seu nombre màssic (nombre de protons més nombre de neutrons).[2]
Nuclis atòmics estables[modifica]
Són els més abundants. En nuclis petits, que tenen un nombre de nucleons (protons més neutrons) menor a quaranta, se sol tractar de nuclis que tenen aproximadament el mateix nombre de neutrons que de protons, cosa que ocorre majoritàriament en aquests elements. No ho compleix, per exemple, l'hidrogen, que no té cap neutró.
En canvi, per a núclids de mida més gran a quaranta nucleons (majors al calci), la relació entre protons i neutrons dels nuclis estables ja és sempre diferent, havent-hi gairebé sempre més neutrons que protons.
Nuclis atòmics inestables o radioactius[modifica]
Els nuclis inestables tenen més protons que neutrons, com per exemple l'hidrogen i tots els de nombre atòmic major a 82 (més grans que el plom). Aquests nuclis tendeixen a perdre energia en forma d'emissions de massa que sempre es deixen anar en el mateix tipus de "paquets". Això vol dir que en principi, de manera natural, no deixen anar, per exemple, un protó, i un altre dia dos, o un tros de nucli qualsevol.[3]
Radioactivitats alfa i beta[modifica]
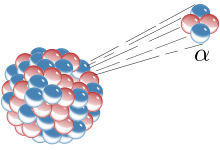

La inestabilitat dels àtoms es manifesta en un procés anomenat radioactivitat, al qual els elements químics amb nuclis inestables tendeixen a perdre sempre el mateix "tros" d'àtom. Hi ha dues possibilitats:
- Alguns isòtops d'elements concrets, o alguns núclids concrets, sempre perden "paquets" compostos per dos neutrons i dos protons enllaçats entre ells: això s'anomena partícula alfa i coincideix amb la composició d'un nucli d'heli (un àtom d'heli sense cap electró). Els elements amb nuclis inestables que emeten partícules alfa estan emetent radioactivitat alfa. De vegades també es parla demissions alfa, que és el mateix. El procés de perdre una partícula alfa es diu desintegració alfa.
- Altres elements o isòtops d'alguns elements, que poden ser, per exemple, el resultant d'un que ha perdut una partícula alfa, emeten sempre un altre "paquet" de matèria, molt més petit, compost només per un positró o per un electró: és una partícula beta. La radioactivitat beta és el fet d'emetre partícules beta, també anomenades emissions beta. El procés de perdre una partícula beta es diu desintegració beta.
El nucli o element químic que perd una partícula alfa o beta es diu que és pare del nucli o element químic resultant, que es diu que és el seu fill. Normalment aquests processos no ocorren a un sol àtom sinó a una mostra que en conté molts. En aquest cas, com a les persones, es parla de generacions.
És habitual que un element radioactiu, o sigui amb el nucli inestable, emeti una o diverses partícules i esdevingui un altre element (o un isòtop de l'anterior) també inestable, que per tant emetrà una altra partícula, esdevenint un altre element diferent, sovint inestable, que també emet radiació, etc. A aquest conjunt d'elements produïts un a partir de l'altre a conseqüència de les seves radiacions se'ls diu cadenes radioactives de l'element X, sent X l'element que la comença. A la natura, a la Terra, hi ha quatre cadenes radioactives naturals principals, com per exemple la cadena del radó.
Altres fenòmens radioactius[modifica]
Alguns nuclis inestables o radioactius són més fàcils de fusionar amb altres. També n'hi ha que són més fàcils de fissionar. En aquestes reaccions nuclears dos nuclis s'uneixen o un nucli es pot trencar en dos, o més rarament en tres, parts que en general no coincideixen amb partícules alfa ni beta, tot i que s'hi poden produir. A les reaccions nuclears s'hi poden emetre neutrons aïllats, per exemple, o fotons. Les reaccions nuclears es poden forçar, és a dir que, per exemple, podem obligar a trencar un nucli (estable o inestable) que altrament no ho faria mai, aportant energia, bombardejant-ho amb neutrons o d'altres maneres. Algunes reaccions nuclears es produeixen en cadena.
Un altre fenomen nuclear possible és l'emissió de fotons, un tipus de radiació electromagnètica. Aquestes emissions no es produeixen per una manca d'estabilitat dels nuclis atòmics sinó que és a causa de l'excitació dels nuclis a conseqüència de reaccions nuclears (com la de fusió o la de fissió) i apareixen sempre amb altres fenòmens radioactius. La radiació gamma (o també radioactivitat gamma) és l'emissió de fotons (també emissions gamma).
Vegeu també[modifica]
- Taula periòdica
- Activitat d'una substància radioactiva
- Radioactivitat natural i radioactivitat artificial
Referències[modifica]
- ↑ Energia nuclear[Enllaç no actiu]
- ↑ Jaume Jorba Bisbal, Agustí Poch Parés, Francisco Calviño Tavares. Física nuclear. Universitat Politècnica de Catalunya, 1996, p.224-226.
- ↑ Física nuclear. Radioactivitat
Enllaços externs[modifica]
- Estabilitat nuclear Arxivat 2016-10-24 a Wayback Machine. ara.ciència
- L'estabilitat del nucli atòmic
