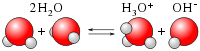Ionització

La ionització és el fenomen per mitjà del qual un àtom o una molècula elèctricament neutres es converteixen en un ió. Aquest procés és diferent, depenent de si es produeix un ió positiu (catió) o negatiu (anió).[1][2][3]
Tant en el camp de la química com en el de la física, la ionització és qualsevol procés pel qual els àtoms o molècules elèctricament neutres es converteixen en àtoms o molècules carregades elèctricament mitjançant el guany o la pèrdua d'electrons (anions i cations, respectivament), que són les partícules carregades situades més a l'exterior dels àtoms. La ionització constitueix una de les principals vies per a la transferència d'energia de la radiació, com ara partícules carregades (partícules α i β) i raigs ultraviolats, cap a la matèria.
Reaccions químiques d'ionització[modifica]
Reaccions àcid-base[modifica]
En el camp de la química, la ionització sovint té lloc dins d'una solució líquida. Per exemple, les molècules neutres del gas clorur d'hidrogen format per molècules on un àtom d'hidrogen i un àtom de clor es troben enllaçats mitjançant enllaç covalent , reaccionen amb les molècules polaritzades d'aigua , també amb enllaços covalents entre els hidrògens i l'oxigen per produir cations oxoni positius , i anions clorur negatius . El procés es pot representar com:[1]
El diòxid de carboni de l'atmosfera reacciona amb l'aigua per donar àcid carbònic (no aïllat) que, en reaccionar amb l'aigua s'ionitza donant anions hidrogencarbonat i cations oxoni:
-
Ionització de l'anilina en la reacció amb cations oxoni.
Moltes altres molècules més complexes també s'ionitzen en dissoldre's en l'aigua o en qualsevol dissolvent polar. És el cas dels àcids carboxílics, com ara l'àcid oleic present a l'oli d'oliva, o les amines, com l'anilina, un important producte industrial.[4]
En el primer cas, l'àcid oleic perd l'hidrogen del grup carboxi i queda carregat negativament; l'hidrogen passa a enllaçar-se a l'oxigen d'una molècula d'aigua i forma un catió oxoni. En el segon cas, l'anilina s'uneix a un hidrogen, mitjançant el grup amino, que pren de l'aigua o d'un catió oxoni i queda carregada, l'anilina, positivament. Les reaccions que tenen lloc són reaccions àcid-base que es poden representar amb les seqüents equacions:[4]
En alguns composts neutres es poden produir reaccions d'ionització entre diferents grups de la mateixa molècula donant lloc a un zwitterió, un compost químic que és elèctricament neutre, però que té càrregues formals positives i negatives en àtoms diferents.[5]
En són exemples els aminoàcids on una petita part de les molècules el grup carboxi ha perdut l'hidrogen, quedant carregat negativament , i l'ha agafat el grup amino , que queda carregat positivament . També s'observa aquest fenomen a l'àcid sulfàmic entre un grup hidroxi i un grup amino.[6]
Autoionitzacions[modifica]
-
.
-
.
L'aigua s'autoionitza donant una petita concentració de cations oxoni i anions hidròxid , amb una concentració cadascun de 10–7 mol/L i una constant d'equilibri molt baixa, Kw = 10–14 a 25 °C. Aquest valor indica que hi ha molt poques molècules d'aigua ionitzades. Malgrat aquesta petita quantitat el fenomen és important i fa que l'aigua sigui un poc conductora de l'electricitat. L'equilibri és:[4]
També l'amoníac sofreix un procés semblant amb una constant d'equilibri encara més baixa, 10–27, la qual cosa significa que l'equilibri està molt poc desplaçat cap a la formació d'ions. Les reaccions assoleixen aviat un equilibri químic, que es poden representar:[4]
Reaccions redox[modifica]

A la superfície d'una peça de zinc metàl·lic en contacte amb una solució àcida, els àtoms de zinc , perden electrons (s'oxiden) a favor dels cations oxoni (que es redueixen a hidrogen gas) i es converteixen en cations de zinc incolors . El mateix passa amb el magnesi i d'altres metalls. Les reaccions es poden representar com:[1]
Processos físics d'ionització[modifica]

En general, la ionització es produeix sempre que partícules carregades o energia radiant prou energètiques travessen gasos, líquids o sòlids.[1]
Ionització per xocs d'electrons[modifica]
La ionització per col·lisió es produeix en gasos a baixes pressions quan s'hi fa passar un corrent elèctric. Si els electrons que conformen el corrent tenen prou energia cinètica (l'energia d'ionització és diferent per a cada substància), expulsen altres electrons de les molècules de gas neutre en xocar-hi, creant parelles d'ions que consisteixen individualment en l'ió positiu resultant i l'electró negatiu desvinculat. A més, també es formen ions negatius quan alguns electrons s'adhereixen a molècules de gas neutre.[1]
Ionització per col·lisions de molècules[modifica]

Els gasos també poden ser ionitzats per col·lisions intermoleculars a altes temperatures.[1] Si les temperatures són extremadament altes, les molècules es mouen a gran velocitat i transporten una energia cinètica molt elevada, els xocs són molt violents i s'expulsen molts d'electrons formant-se una mescla d'electrons i cations. És l'estat de la matèria anomenat plasma. Un plasma d'hidrogen completament ionitzat, format únicament per electrons i protons (nuclis d'hidrogen), és el plasma més elemental. En alguns casos rars els electrons que falten d'un tipus d'àtom o molècula s'uneixen a un altre component, donant lloc a un plasma que conté cations i anions. El cas més extrem d'aquest tipus es produeix quan partícules de pols petites, però macroscòpiques, es carreguen en un estat anomenat plasma polsós.[7]
La singularitat de l'estat del plasma es deu a la importància de les forces elèctriques i magnètiques que actuen sobre un plasma, a més de forces com la gravetat que afecten totes les formes de matèria. Com que aquestes forces electromagnètiques poden actuar a grans distàncies, un plasma actuarà col·lectivament com un fluid fins i tot quan les partícules poques vegades xoquen entre elles. Gairebé tota la matèria visible de l'univers existeix en estat de plasma, predominantment d'aquesta forma al Sol i els estels i a l'espai interplanetari i interestel·lar. Les aurores, els llamps i els arcs de soldadura també són plasmes, els plasmes existeixen en les làmpades de neó i els llums fluorescents, en l'estructura cristal·lina dels sòlids metàl·lics i en molts altres fenòmens i objectes. La Terra mateixa està immersa en un plasma tènue anomenat vent solar i està envoltada d'un plasma dens anomenat ionosfera.[7]
Ionització per partícules de radioactivitat[modifica]

Els núclids que són inestables es desintegren per aconseguir estabilitat emetent partícules α (nuclis d'heli, per tant, amb càrrega positiva), partícules β– (electrons amb càrrega negativa), partícules β+ (positrons amb càrrega positiva), neutrins i antineutrins i neutrons. Totes aquestes partícules surten a gran velocitat dels nuclis atòmics amb una energia cinètica elevada que van perdent xocant amb els electrons dels àtoms o molècules que troben al seu pas. Així aquests àtoms o molècules queden ionitzats formant cations. Els electrons expulsats poden ser absorbits per altres àtoms o molècules formant anions. Els electrons energètics resultants del pas de partícules carregades poden causar, al seu torn, una ionització addicional, anomenada ionització secundària. Les partícules carregades (partícules α i partícules β) provoquen una ionització extensa al llarg del seu recorregut. En canvi, partícules neutres energètiques, com ara neutrons i neutrins, tenen una major capacitat de penetració i causen gairebé cap ionització.[8]
Ionització per radiació electromagnètica[modifica]

Polsos de radiació electromagnètica, com ara fotons de raigs ultraviolats, poden expulsar electrons dels àtoms mitjançant l'efecte fotoelèctric, i així provoquen la ionització. Els electrons energètics resultants de l'absorció d'energia radiant poden causar, al seu torn, una ionització addicional, anomenada ionització secundària. A la nostra atmosfera terrestre, hi ha un nivell mínim d'ionització a causa de l'absorció contínua dels raigs còsmics procedents de l'espai i de la radiació ultraviolada del Sol.[1]
Energia d'ionització[modifica]
L'energia d'ionització, simbolitzada E1, és la mínima energia necessària per a extreure un electró d'un àtom neutre o molècula en el seu estat fonamental. Aquesta energia es mesura habitualment en joules per mol (J/mol) o en electró-volts (eV). Antigament s'anomenava potencial d'ionització.[9] Per a un àtom neutre X, el procés es pot simbolitzar amb l'equació següent:
S'anomena segona energia d'ionització, simbolitzada E₂, l'energia necessària per a extreure el segon electró, després d'haver extret ja el primer. És a dir, l'energia per al procés:
Per als electrons successius, es defineixen la tercera, quarta, etc., energies d'ionització. Els valors de totes les energies d'ionització d'un mateix àtom i per a tots els àtoms és sempre positiva, ja que la ionització és un procés endotèrmic. Cal aportar energia a l'àtom per deslligar els seus electrons de les forces d'atracció que els mantenen units al nucli atòmic. Els electrons extrets sempre són els que es troben més feblement units al nucli, això és, els situats a la capa més externa de l'escorça electrònica. És un procés que es pot entendre com la promoció del darrer electró de l'àtom, situat al nivell més alt ocupat, fins al nivell infinit. Per al sodi tindríem:
Com indica la definició, també és possible la ionització de molècules, com ara dioxigen, O₂, monòxid de carboni, CO, diòxid de nitrogen, NO₂, etc. En el cas de l'oxigen, el procés es pot representar amb l'equació:
Taula[modifica]
Aquesta taula mostra les transicions de fase de la matèria, indicant com s'anomena el canvi d'estat en cada cas.
| Sòlid | Líquid | Gas | Plasma | |
|---|---|---|---|---|
| Sòlid | Fusió | Sublimació | ||
| Líquid | Solidificació | Vaporització | ||
| Gas | Sublimació inversa | Condensació | Ionització | |
| Plasma | Recombinació |
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 «Ionization | Definition, Examples, & Facts | Britannica» (en anglès). [Consulta: 19 novembre 2022].
- ↑ «ionizzazione nell'Enciclopedia Treccani» (en italià). [Consulta: 21 novembre 2022].
- ↑ «Ionization - Energy Education» (en anglès). [Consulta: 23 novembre 2022].
- ↑ 4,0 4,1 4,2 4,3 4,4 Atkins, P.W.. Shriver & Atkins' inorganic chemistry. 5th ed. Oxford: Oxford university press, 2010. ISBN 978-0-19-923617-6.
- ↑ IUPAC., IUPAC Compendium of Chemical Terminology, Electronic Version «Còpia arxivada». Arxivat de l'original el 2007-01-29. [Consulta: 27 juliol 2023].. Retrieved November 12, 2006.
- ↑ Morrison, R.T.; Boyd, R.N.. Química orgánica. Argentina: Pearson Educación, 1998. ISBN 9789684443402.
- ↑ 7,0 7,1 Kelley, Michael C.; Liley, Bruce Sween; Potter, Simeon. «plasma». Encyclopedia Britannica, 05-09-2022. [Consulta: 27 juliol 2023].
- ↑ Ferrer Soria, Antonio; Ros Martínez, Eduardo. Física de partículas y de astropartículas. València: Publicacions de la Universitat de València, 2005. ISBN 9788437061801.
- ↑ McNaught, A.D.; Wilkinson, A. IUPAC. Compendium of Chemical Terminology, the "Gold Book" (en anglès). 2a edició. Oxford: Blackwell Scientific Publications, 1997. DOI 10.1351/goldbook.I03199. ISBN 0-9678550-9-8 [Consulta: 13 març 2027].
Vegeu també[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Ionització |