Isòmer

Un isòmer és un compost que presenta isomeria. La isomeria és un fenomen que presenten certs composts orgànics que malgrat tenir la mateixa fórmula molecular tenen propietats físiques i químiques diferents. Per exemple, l'etanol i l'èter dimetílic són isòmers, tenen propietats físiques (punts de fusió i ebullició, etc.) i químiques diferents (tipus de reaccions), però la mateixa fórmula molecular . La causa és que hi ha un o més àtoms que tenen enllaços diferents.
El mot «isòmer» prové del grec ἰσομερής isomerḗs [compost de ἴσος iso- 'igual' + -μέρης -mér(ēs) «dividit en parts», «segment», «part»]. És una paraula existent en l'antiguitat que fou reintroduïda amb un significat diferent el 1830 pel químic suec Jöns Jacob Berzelius.[1]
Història[modifica]

Els compostos amb diferents propietats físiques o químiques, però amb la mateixa fórmula molecular, és a dir, el mateix tipus i el mateix nombre d'àtoms, però amb una disposició diferent, eren coneguts a finals del segle XVIII. Tot i que era ben sabut que una determinada substància podia ser sòlida, líquida o gasosa a diferents temperatures, si l'anàlisi demostrava que tenia una composició definida, se n'establia la seva identitat. No obstant això, a principis del segle XIX, es descobriren diverses substàncies amb la mateixa composició però propietats diferents. El 1812, el químic suec Jöns Jacob Berzelius (1779-1848) considerà que les dues varietats d'àcid estànnic diferien en la composició, però el francès Joseph-Louis Gay-Lussac (1778-1850) el 1816 demostrà que tenien la mateixa composició. El 1817, Berzelius comprovà que malgrat tenir la mateixa composició tenien propietats diferents. El 1814, Gay-Lussac observà que l'àcid acètic i la cel·lulosa tenien la mateixa composició (fórmula empírica, malgrat que estudis posteriors demostraren que no és així) i conclogué que «la disposició de les molècules (àtoms en el sentit modern), en un compost té la influència més gran en el seu caràcter neutre, àcid o alcalí».[2]
El 1819, el mineralogista i metal·lúrgic alemany Carl Johann Bernhard Karsten (1782-1853), citant el mineralogista alemany Johann Ludwig Georg Meinecke (1781-1823), proposà que els composts amb el mateix nombre d'àtoms podrien tenir-los disposats de manera diferent.[2]
El químic alemany Friedrich Wöhler (1800-82) descobrí el 1824 que la composició del cianat d'argent era idèntica a la del fulminat d'argent, segons el que havien determinat Gay-Lussac i Justus von Liebig (1803-73), però tenien propietats clarament diferenciades. El 1830, Berzelius anomenà als àcids tartàric i racèmic (que tenen la mateixa composició) «cossos isomèrics» (en suec, isomeriska kroppar).[3] El 1831 suggerí el terme «isomerisme» («isòmer» prové del grec ἰσομερής isomerḗs «compost de parts iguals») per al fenomen de composts amb la mateixa composició, però propietats diferents, donant cinc exemples: àcids ciànic i fulmínic , àcids tartàric i racèmic (ambdós ), cianat d'amoni i urea , els dos àcids estànnics i els dos àcids fosfòrics, dels quals només els tres primers eren correctes.[2]
El 1831 distingí l'isomerisme del que posteriorment anomenà «polimerisme» (ara un terme obsolet), el fenomen de dues substàncies diferents amb el mateix nombre relatiu d'àtoms (fórmula empírica) però diferent nombre absolut d'àtoms (fórmula molecular). Utilitzà com a exemple el gas olefiant (l'etè ) i el gas butilè (but-1-è o but-2-è , fórmula empírica ), descobert per Michael Faraday (1791-1867) el 1825.[2]
El treball clàssic sobre els isòmers òptics de l'àcid tartàric fou realitzat pel químic francès Louis Pasteur (1822-1895), que el 1848[4] separà laboriosament els isòmers (+) i (–) amb l'ajuda d'una lupa de la seva mescla racèmica (una barreja òpticament inactiva de quantitats iguals de cada enantiòmorf).[2]
El concepte de tautomeria fou descobert el 1876 pel químic rus Aleksandr Mikhàilovitx Bútlerov (1828–1886), però no fou fins al 1885 que el químic alemany Peter Conrad Laar comprengué en tota la seva extensió els fenòmens de tautomeria i els definí en el sentit actual. Un altre avanç important el proporcionà l'aïllament de les primeres formes ceto i enol per part de Rainer Ludwing Claisen (1851–1930) el 1896.[5]
Isomeria estructural[modifica]
En la isomeria plana o estructural les diferències es troben en la connectivitat entre els àtoms. A causa d'això es poden presentar 3 diferents modes d'isomeria:
- Isomeria de cadena o esquelet
- Isomeria de posició
- Isomeria de grup funcional
Isomeria de cadena[modifica]
Els isòmers que presenten isomeria de cadena difereixen en l'esquelet hidrocarbonat. Un exemple d'isòmers de cadena són els tres isòmers del pentà: n-pentà, isopentà (2-metilbutà) i neopentà (2,3-dimetilpropà), tots tres amb la fórmula química , però amb propietats diferents.[6]
Els alcans, amb fórmula general , presenten un nombre d'isòmers estructurals que creix exponencialment amb . Per a hi ha els tres que es mostren a la figura; per a el nombre d'isòmers estructurals ja puja a 75; per a n'hi pot haver 5,25 × 1013; per a s'ha calculat que superen els 9,43 × 1083, que ja són més que el nombre de partícules de l'univers observable (~1080).[7]

|

| |
| 1-Pentanol | 2-Pentanol | 3-Pentanol |
Isomeria de posició[modifica]
Els isòmers de posició tenen les mateixes cadenes de carbonis però amb els mateixos grups funcionals situats en diferents llocs de la cadena. Un exemple simple d'aquest tipus d'isomeria són els tres isòmers del pentanol: l'1-pentanol, el 2-pentanol i el 3-pentanol. Tots tenen la mateixa fórmula , amb el mateix grup funcional que caracteritza els alcohols, un grup hidroxi , però situat en posicions diferents, la qual cosa dona lloc a lleugeres diferències en les seves propietats.[6]

|

|
|
| Propanona | Propanal | Prop-2-en-1-ol |
Isomeria de grup funcional[modifica]
En aquest tipus d'isomeria estructural la diferent connectivitat dels àtoms poden generar diferents grups funcionals en la cadena. Un exemple és la propanona, el propanal i el prop-2-en-1-ol que tenen la mateixa fórmula molecular , però presenten grups funcionals diferents: cetona, aldehid i alcohol, respectivament. Les seves propietats, com a tots els isòmers, són significativament diferents.[6]
Estereoisomeria[modifica]

Els estereoisòmers tenen els àtoms interconnectats de la mateixa manera, però les diferències es troben en l'ordenació espacial dels àtoms. El terme «estereoisòmer» fou utilitzat per primera vegada pel químic alemany Victor Meyer (1848-97) el 1888.[2]
Isomeria geomètrica[modifica]
L'isomerisme cis/trans o E/Z és una forma d'estereoisomerisme que descriu l'orientació dels grups funcionals dins una molècula. En general aquests isòmers tenen doble enllaç, que no poden rotar, però també poden sorgir d'estructures en anell, on la rotació dels enllaços està molt restringida. Els isòmers cis i trans es donen tant en molècules orgàniques com en complexos de coordinació de molècules inorgàniques.[6]
-
Isòmer cis de l'1,2-dicloroetè. Els àtoms verds de clor estan a la mateixa part.
-
Isòmer trans de l'1,2-dicloroetè. Els àtoms verds de clor estan oposats.
Els termes cis i trans provenen del llatí, en el qual cis significa «al mateix lloc» i trans, «a l'altre costat».[6]
El sistema cis/trans per donar nom als isòmers no és efectiu quan hi ha més de dos substituents diferents en un doble enllaç. Es pot usar el sistema de notació E/Z. La Z és de l'alemany zusammen que vol dir «junt» i correspon al terme cis; E (de l'alemany entgegen) significa «oposat» i correspon a trans.[6]
Quan una configuració molecular es designa E o Z s'ha determinat per la regla de prioritat de Cahn-Ingold-Prelog; els nombres atòmics més alts donen la prioritat més alta.[6]
Isomeria òptica o enantiomeria[modifica]
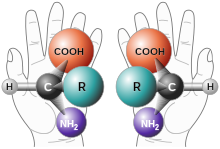
Quan un compost té almenys un àtom de carboni asimètric o quiral, és a dir, un àtom de carboni amb quatre substituents diferents, poden formar-se dues varietats diferents anomenades estereoisòmers òptics, enantiòmers o formes quirals, encara que tots els àtoms estan en la mateixa posició i enllaçades de la mateixa manera. Els isòmers òptics no es poden superposar i un és com la imatge especular de l'altre, com ocorre amb les mans dreta i esquerra. Presenten les mateixes propietats físiques i químiques, però es diferencien que desvien el pla de la llum polaritzada en diferent direcció: un cap a la dreta (en orientació amb les manetes del rellotge) i es representa amb la lletra (d) o el signe (+) (isòmer dextrogir o forma dextro) i un altre a l'esquerra (en orientació contrària amb les manetes del rellotge) i es representa amb la lletra (l) o el signe (-) (isòmer levogir o forma levo).[8]

Si una molècula té n àtoms de carboni asimètrics, tindrà un total de 2n isòmers òptics.
Nomenclatura[modifica]
El sistema més utilitzat per anomenar els diferents enantiòmers és el sistema R/S, que s'utilitza per determinar la configuració absoluta dels carbonis quirals.[6]
Forma racèmica[modifica]
Una mescla racèmica o racemat és la barreja equimolecular dels isòmers dextro i levo. Aquesta fórmula és òpticament inactiva (no desvia el pla de la llum polaritzada). Per a designar un racemat se sol anteposar al nom del compost els prefixos (±)-, rac- (o racem-) o (RS)- o (SR)-. Per exemple, (±)-2-clorobutà, rac-2-clorobutà (o racem-2-clorobutà) i (RS)-2-clorobutà (o (SR)-2-clorobutà).[9]
Poder rotatori específic[modifica]
El poder rotatori específic és el gir angular que sofreix el pla de polarització quan un feix de llum polaritzada travessa una dissolució que contingui 1 gram de substància per cm³ en un recipient d'1 decímetre de longitud. És funció de la longitud d'ona de la llum emprada i li és adjudicat el signe + o –, segons que la substància sigui dextrògena o levògira.[10]
Isomerisme conformacional[modifica]

La isomeria conformacional, o isomerisme conformacional, és una forma d'estereoisomerisme en la qual els isòmers presenten diferents conformacions i poden ser interconvertits exclusivament per rotacions sobre enllaços simples.[11] Aquests isòmers normalment s'anomenen com isòmers conformacionals o confórmers i, específicament, com rotàmers[12] quan difereixen per rotació sobre un enllaç simple.
Tautomeria[modifica]

La tautomeria, tautomerisme o isomeria dinàmica, és un equilibri químic entre dos isòmers que són anomenats tautòmers. Compleix la fórmula general:
Referències[modifica]
- ↑ «Dicciomed: Diccionario médico-biológico, histórico y etimológico» (en castellà). [Consulta: 14 setembre 2023].
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Browne, Janet; Porter, Roy; Bynum, William F. Dictionary of the history of science. Londres: Macmillan, 1981. ISBN 978-0-333-29316-4.
- ↑ Berzelius, J. J. «Ueber die Milchsäure». Annalen der Physik und Chemie, 95, 5, 1830, pàg. 26–33. DOI: 10.1002/andp.18300950503. ISSN: 0003-3804.
- ↑ Pasteur, L. «Mémoire sur la relation qui peut exister entre la forme crystalline et la composition chimique, et sur la cause de la polarisation rotatoire». C. R. Séances Acad. Sci., 26, 1848, pàg. 538–538.
- ↑ Klages, F. Tratado de Química Orgánica. Tomos I y II (en castellà). Barcelona: Reverté, 1969. ISBN 8429173110.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Carey, Francis A. Química orgánica. 6a ed. México: McGraw Hill, 2006. ISBN 970-10-5610-8.
- ↑ Davies, Robert E.; Freyd, Peter J. «C167H336 is the smallest alkane with more realizable isomers than the observed universe has "particles"» (en anglès). Journal of Chemical Education, 66, 4, 1989-04, pàg. 278. DOI: 10.1021/ed066p278. ISSN: 0021-9584.
- ↑ Química general; 8ª edición; Petrucci, Harwood y Herring; Prentice Hall; ISBN 0-13-014329-4
- ↑ UNIVERSITAT POLITÈCNICA DE CATALUNYA; TERMCAT, CENTRE DE TERMINOLOGIA; ENCICLOPÈDIA CATALANA. Diccionari de química [en línia]. Barcelona: TERMCAT, Centre de Terminologia, cop. 2016-2023. (Diccionaris en Línia) (Ciència i Tecnologia) <{{format ref}} http://www.termcat.cat/ca/diccionaris-en-linia/212>
- ↑ INSTITUT D'ESTUDIS CATALANS; FUNDACIÓ ACADÈMIA DE CIÈNCIES MÈDIQUES I DE LA SALUT DE CATALUNYA I DE BALEARS; ENCICLOPÈDIA CATALANA; TERMCAT, CENTRE DE TERMINOLOGIA; CATALUNYA. DEPARTAMENT DE SALUT. Diccionari enciclopèdic de medicina (DEMCAT): Versió de treball [en línia]. Barcelona: TERMCAT, Centre de Terminologia, cop. 2015-2021 (Diccionaris en Línia) <{{format ref}} http://www.termcat.cat/ca/diccionaris-en-linia/183/>
- ↑ IUPAC definition of a conformer.
- ↑ IUPAC, Compendium of Chemical Terminology, 2a ed. ("The Gold Book") (1997). Versió corregida en línia: (1996) "Rotamer" (en anglès).
- ↑ IUPAC, Compendium of Chemical Terminology, 2a ed. ("The Gold Book") (1997). Versió corregida en línia: (2019) "tautomerism" (en anglès).
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Isòmer |