Micel·la
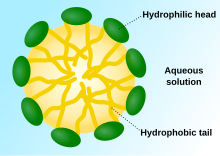
Una micel·la (del llatí mica: “molla”) és un conglomerat de molècules que formen una monocapa biològica quan es troba en fase col·loide i que té certes propietats tensioactives i/o anfifíliques. Les micel·les són les úniques membranes cel·lulars que estan formades per una sola capa lipídica en comptes de formar una bicapa lipídica. Les estructures de les micel·les poden adquirir diferents formes: esfèriques, cilíndriques, laminals i discoïdals. La forma i grandària depenen de les molècules surfactants que les formen així com les condicions físico-químiques de la solució: la concentració de surfactants, el pH, la temperatura i la força iònica. El procés de formació de micel·les s’anomena micel·lització, i forma part del comportament de fase de molts lípids acord amb el seu polimorfisme. El diàmetre d’aquestes oscil·la entre els 10-20 nm aproximadament.
Formació[modifica]
Els aglomerats micel·lars es formen quan, en condicions de temperatura iguals o superiors a la temperatura de Krafft, la concentració del tensioactiu supera un cert nivell crític, denominat concentració micel·lar crítica (CMC). En aquest moment és quan determinades propietats físico-químiques del sistema (tensió superficial, variació de la pressió osmòtica, etc.) sofreixen un canvi brusc. La CMC es pot determinar experimentalment a partir d’una dissolució realitzant canvis en les propietats físiques
En dissolvents polars, com l’aigua, els àcids grassos s’agrupen pels seus grups hidrofòbics en forma de falca, de manera que les cadenes alquil es troben girades cap a dins de la monocapa mentre que els caps polars dels àcids grassos interaccionen amb les molècules d’aigua.
En dissolvents apolars l’orientació dels caps polars i apolars és a la inversa (es parla de micel·la inversa), en l’interior de la qual hi ha una microgota d’aigua de dimensions variables. Aquestes resulten útils com a mètode de compartemització, per tal que es puguin donar reaccions químiques en ambients no convencionals (p. ex. en medi aquós asèptic, és a dir, absolutament estèril)

Quan la concentració del tensioactiu supera la CMC es verifica l’efecte emulsionant. Així, les micel·les formades a partir de sabons o detergents en solució aquosa, engloben a l’interior la brutícia (grassa), afavorint així la seva eliminació.
La formació de micel·les és essencial per a l'absorció de vitamines solubles en grasses i lípids complexes de l’ésser humà. Les sals biliars formades en el fetge i secretades per la vesícula biliar permeten la formació de micel·les d’àcids grassos. Gràcies a això es pot realitzar l'absorció de lípids complexos (com per exemple la lecitina) i de vitamines (A, D, E i K) dintre de la micel·la per l’intestí prim.
Història i models[modifica]
La capacitat d’una solució sabonosa per actuar com a detergent ha estat reconegut des de fa segles. No obstant això, no va ser fins al principi del segle XX que la constitució d'aquestes solucions va ser estudiat científicament. El primer a postular l'existència d'ions col·loïdals per explicar la bona conductivitat elèctrica de solucions de palmitat de sodi va ser James William McBain, químic de la Universitat de Bristol, l’any 1913. McBAin va constatar que les molècules de tensioactius dissoltes en aigua podien agregar-se de mode reversible, i va nomenar micel·la a aquests agregats. Va ser G.S. Hartley el 1935 qui va descriure el primer model d'una micel·la.[1] La mida total de la micel·la la va concebre com gairebé esfèrica de 50 a 200 monòmers disposats amb la part lipofílica dirigida cap a la zona central i els hidròfils cap a l'exterior. El radi de la micel·la és aproximadament equivalent a la longitud de la cadena d'hidrocarburs, mentre que en les capes exteriors es troben presents els contraions (aquells ions presents a la solució i cap als quals la micel·la té un certa atracció electroestàtica): la capa de Stern està formada per la part que consta dels grups dels caps dels tensioactius que envolten els contraions, els quals es troben fortament lligats; la capa de Gouy-Chapman és aquella més exterior i conté els contraions restants, que en aquest cas són independents de la micel·la i poden ser intercanviats lliurement en la solució. El model de Stern i el model de Gouy-Chapman en l’actualitat s’utilitzen de forma combinada per parlar de les dobles capes elèctriques.
Fer nota però que l'agregat micel·lar no és elèctricament neutre. La raó d'això rau en les interaccions que entren en joc en la formació dels agregats i de la seva entitat. Tenim les cadenes hidròfobes que interaccionen a través d'interaccions de curta distància, i per això si interaccionen s’han de trobar molt a prop. D’altra banda, tenim les parts polaritzades, que interaccionen a través de la llei de Coulomb, interaccions a llarga distància. Quan es forma la micel·la els extrems tendeixen a rebutjar-se entre si, de manera que hi hagi una distorsió a l’hora de tancar els grups dels extrems. Si imaginem els grups terminals completament neutres, aquests es troben en una condició que desafavoreix la formació de micel·les, ja que no hi ha una part carregada que pugui interaccionar amb l'aigua, i d’aquí es dedueix que el tensioactiu, amb la seva cadena hidròfoba, flocula. Això explica, per exemple, per què la capacitat detergent d'un tensioactiu depèn de la concentració d'ions en la dissolució (especialment de l’ió carbonat pels tensioactius catiònics). La porció d’ions no associats a l’agregat micel·lar (és a dir, aquells de la capa de Gouy-Chapman) depèn del volum d'estèrics en els grups terminals (els que es troben a prop de la part carregada).
Posteriorment, el 1979, F.M. Menger, va observar com era pràcticament impossible tenir seixanta molècules amb una simetria radial, sense que hi hagués formació de cavitats centrals. D'aquesta manera, va introduir el concepte de "butxaca aquosa", segons el qual les cavitats són plenes d'aigua a causa d'algunes cadenes de monòmers que sobresurten cap a l'exterior. El model de micel·la resulta doncs significativament més irregular, amb un "cor micel·lar" de volum inferior respecte a aquell proposat per Hartley.
Un altre model digne d'esmentar és el proposat per P. Fromherz en el 1980, que considera les micel·les com agregats de blocs de surfactants constituïts de subunitats de doblets i triplets que tenen entre ells cadenes paral·leles i disposades ortogonalment. El lligam amb els contraions disminueix la repulsió possible entre els caps iònics, i la micel·la adopta així una forma gairebé esfèrica i al mateix temps està assegurat un bon embalatge de les cadenes d'hidrocarburs.
Termodinàmica[modifica]
Entre els models més simples i utilitzats en l'estudi de la termodinàmica de les micel·litzacions destaquen el "model de separació de fases" i el "model del pseudoequilibri químic", el qual es basa en l’aplicació de la llei d'acció de masses.
El model de separació de fases considera la micel·la com una microfase, separada de la solució, que sorgeix com a resultat d'un procés altament cooperatiu que té lloc una vegada que arriba a la concentració micel·lar crítica (CMC) de surfactant. A la pràctica, la CMC pot ser assimilada a la solubilitat dels monòmers en solució. El problema d’aquest model és que no explica per què les diferents microfases no s’uneixen per tal de formar una única fase.
El model d'acció de masses es basa en l'existència d’un equilibri múltiple en la solució entre monòmers i micel·la. Els equilibris són expressats a través d'equacions del tipus
- A1 ⇄ An (on n=2,3…)
amb constant d'equilibri , o del tipus relatiu a processos consecutius
- A1 + An-1 ⇄ An (on n=2,3…)
amb constant d'equilibri .
L’assoliment de la temperatura de Krafft té l'efecte d'augmentar el desordre portant a la destrucció de l'estructura cristal·lina formada pel tensioactiu. La formació de la micel·la està lligada principalment a factors entròpics derivats de la interacció hidrofòbica de les cadenes alquil col·locades dins del cor de la micel·la, interacció que evita el contacte amb l'aigua i causa la destrucció de l'estructura organitzada en la qual les molècules de dissolvent envolten a les cadenes hidrocarburades monomèriques. Evidències experimentals demostren que l'entalpia de la micel·lització té valors generalment baixos.
Productes i aplicacions[modifica]
Detergents sintètics[modifica]
Els detergents més importants per les membranes biològiques són els detergents sintètics, els quals posseeixen una estructura amfipàtica i construeixen micel·les en dissolució aquosa. Detergents especialment utilitzats són el SDS (sodium dodecylsulfa), prototip de detergent iònic, el Tritó X-100 (polioxietilé-p-t-octilfenol) i l'octil-β-glucosídic, ambdós últims representants de detergents no iònics.
Sabons[modifica]
Els detergents produïts com sals de sodi (Na+) i de potassi (K+) dels àcids grassos originats per tractament alcalí dels greixos naturals són els anomenats sabons, que tenen una estructura natural. Les molècules s’enllacen entre si pels seus extrems hidròfobs corresponents a les parts hidrocarbonades de la cadena de l’àcid gras, mentre que la part polar (extrem hidròfil) es troba ionitzada negativament per la pèrdua d’un ió potassi o sodi, de manera que es repel·leixen entre si. Així les cadenes no polars del sabó no entren en contacte amb l’aigua i l'extrem carregat negativament és l’única part que es troba exposada a aquesta.
Altres[modifica]
A més de trobar-se en detergents, les micel·les es poden trobar en mesofase liotròpica de cristalls líquids i intervenen en el mecanisme de nombrosos processos biològics.
La formació de micel·les s’utilitza en cinètica química per l'estudi de reaccions. Altres aplicacions d’interès són la solubilització de productes agrícoles i substàncies colorants, l’ús en preparats farmacèutics, en processos fotogràfics, en l'electrosíntesi orgànica o com inhibidor de la corrosió. Un altre ús important seria en la recuperació terciària de petroli.
Referències[modifica]
- ↑ G.S. Hartley, Aqueous Solutions of Paraffin Chain. Salts, A study of Micelle Formation, Herman and Co., Parigi (1936).
Bibliografia[modifica]
- J.W. McBain, Trans. Faraday Soc. 9, p.99 (1913).
- J.M. Seddon, R.H. Templer, Polymorphism of Lipid-Water Systems, from the Handbook of Biological Physics, Vol. 1, Ed. R. Lipowsky, and E. Sackmann. (c) 1995, Elsevier Science B.V. ISBN 0-444-81975-4.
- S.A. Baeurle, J. Kroener, Modeling effective interactions of micellar aggregates of ionic surfactants with the Gauss-Core potential, J. Math. Chem. 36, pp. 409-421 (2004).
- MÜLLER-ESTERL, Werner, Bioquímica: fundamentos para Medicina y Ciencias de la vida; [Versión española por Josep Joan Centelles Serra]. Barcelona, Reverté (2008).
Vegeu també[modifica]
Enllaços externs[modifica]
- Revista Iberoamericana de polímeros; Micelas. Vol. 4(2) Abril 2003. (en Castellà)

![{\displaystyle K_{n}={\frac {[A_{n}]}{[A_{1}]^{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/530615bc2f1f31ce6b094c3add5d66363604c053)
![{\displaystyle K'_{n}={\frac {[A_{n}]}{[A_{1}][A_{n-1}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c32b4f4aa1a222716fca8e2e6f41cbb637d45610)