Nanotecnologia de l'ADN

La nanotecnologia de l'ADN és una branca de la nanotecnologia que utilitza les propietats del reconeixement molecular de l'ADN i altres àcids nucleics per a crear estructures artificials d'ADN dissenyades amb propòsits tecnològics. En aquest camp, l'ADN és utilitzat no tant com a portador d'informació genètica, sinó com a material estructural: n'és un exemple la bionanotecnologia. La nanotecnologia de l'ADN té aplicacions en l'autoensamblatge molecular i en la computació basada en l'ADN.
Tot i que normalment, en el context de biologia molecular, l'ADN és considerat com el portador de la informació genètica en cèl·lules vives, la nanotecnologia de l'ADN considera l'ADN únicament com a material i producte químic, utilitzant-lo, en general, fora del context biològic. La nanotecnologia de l'ADN utilitza el fet que, degut a l'especificitat dels parells de bases del model de Watson-Crick, només les porcions de cadenes que són complementàries entre si s'uneixen per a formar dúplexs d'ADN. La nanotecnologia de l'ADN intenta fer unions entre diverses cadenes d'ADN a través del disseny racional de tal manera que les porcions desitjades de cada cadena s'uneixin en la posició correcta per a obtenir una estructura desitjada, un procés que s'anomena disseny d'àcids nucleics.
Tot i que el camp s'anomena nanotecnologia de l'ADN, els principis que predica poden ser igualment aplicats a altres àcids nucleics com poden ser l'ARN i l'APN. Per aquesta raó el camp també pot ser anomenat com nanotecnologia dels àcids nucleics.
Conceptes fonamentals[modifica]


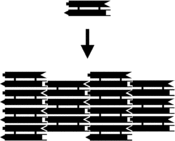
La nanotecnologia de l'ADN crea estructures complexes a partir dels àcids nucleics utilitzant l'especificitat de l'aparellament de bases en aquest tipus de molècules. L'estructura de la molècula d'àcid nucleic consisteix en una seqüència de nucleòtids, distingits per la base nitrogenada per la que estan formats. Les quatre bases que poden formar una molècula d'ADN són l'adenina (A), la citosina (C), la guanina (G) i la timina (T). Les molècules d'àcids nucleics tenen una gran especificitat, de tal manera que dues molècules s'uniran per a formar una estructura de doble hèlix només si les dues seqüències a unir tenen les bases nitrogenades complementàries, sempre tenint en compte que les adenines (A) només s'uneixen a timines (T) i les citosines (c) només s'uneixen a guanines(G). Com que la unió dels parells de bases correctes és energèticament favorable, s'espera que les cadenes d'àcids nucleics s'uneixin maximitzant el nombre de parells correctes. El fet que la seqüència de bases determini el patró d'unió i l'estructura global de la molècula, s'utilitza en el camp de la nanotecnologia de l'ADN on les seqüències són dissenyades artificialment de tal manera que l'estructura desitjada és la que, amb major probabilitat (com s'ha dit abans per un tema d'energies favorables) es formarà.[3]
Gairebé totes les estructures en la nanotecnologia de l'ADN usen molècules d'ADN ramificat que continguin unions, a diferència de la majoria d'ADN biològic que està format per una doble hèlix lineal. Una de les estructures ramificades més senzilles, i la primera que es va sintetitzar artificialment, és la unió de quatre branques, que pot ser sintetitzada utilitzant quatre seqüències d'ADN complementàries ordenades segons la seqüència patró. A diferència de les unions de Holliday naturals, les unions immòbils artificials de quatre braços, tenen una seqüència de bases diferent a cada branca, el que implica que el punt d'unió està fixat en una certa posició.[3]
Les unions poden ser utilitzades en molècules més complexes. Una de les unions més utilitzades, és la “doble creuada” o patró DX. Una molècula de DX es pot considerar com dos dúplex d'ADN posicionats paral·lelament amb dos punts d'encreuament on dues cadenes es creuen des d'un dúplex a l'altre. Cada punt d'unió és en si topològicament una cruïlla de quatre braços. Això fa que el patró DX sigui recomanable com a element estructural dels complexos d'ADN.[3]
Disseny[modifica]
Les nanoestructures de l'ADN han de ser disseny racional de tal manera que les cadenes simples d'àcids nucleics s'uneixin formant les estructures desitjades. El procés de disseny d'aquestes nanoestructures sovint comença amb la concreció d'una estructura de destinació i/o una funció. En aquest moment l'estructura secundària general de la molècula objectiu es dissenya, el que significa que es dissenya la disposició de les cadenes d'àcid nucleic simples en el conjunt de l'estructura, i en quines proporcions aquestes cadenes haurien d'estar unides entre elles. L'últim pas és el disseny de l'seqüència d'ADN, és a dir, la concreció de les seqüències de bases de cada cadena d'àcids nucleics.[4]
Disseny estructural[modifica]
El primer pas en el disseny de la nanoestructura d'un àcid nucleic és decidir com una estructura hauria d'estar representada per la unió específica de cadenes d'àcids nucleics. Aquest disseny, per tant, determina l'estructura secundària, i les sèries de parells de bases que mantenen les cadenes individuals unides en l'estructura desitjada. Hi ha diversos models que s'han portat a terme:
- Estructures basades en rajoles. Trenca les estructures en unitats més petites amb una unió forta entre les cadenes que contenen cada unitat, i una interacció relativament menor entre les unitats. Normalment s'usa per a fer enreixats, però també pot ser usada per implementar l'autoensamblatge algorítmic formant la plataforma base de la computació basada en ADN.[5]
- Estructures de plegament. Com a alternativa al model anterior, les estructures de plegament fan les nanoestructures a partir d'una única cadena llarga. Aquesta cadena llarga pot tenir una seqüència dissenyada de tal manera que es plegui sobre ella mateixa degut a interaccions internes o bé pot estar plegada en la forma desitjada utilitzant cadenes ‘grapa’ més curtes. Aquest últim mètode s'anomena origami de l'ADN i permet la creació de formes a una nanoescala, en 2 i 3 dimensions utilitzant l'ADN.[6]
- Unió cinètica. Recentment hi ha hagut un interès a controlar la cinètica de l'autoensamblatge d'ADN, de tal manera que la dinàmica transitòria pot estar també programada en l'ensamblatge. Aquest mètode també té l'avantatge d'operar isotèrmicament i per tant no requereix un aparellament termal, pas requerit en els diversos models termodinàmics.[7]
Disseny de seqüència[modifica]
Mentre que qualsevol dels enfocs anteriors serveixen per al disseny de l'estructura secundària d'una molècula objectiu, és necessària la concreció d'una seqüència de nucleòtids per a obtenir la formació d'una estructura desitjada. El disseny d'àcids nucleics, el camp central de a nanotecnologia de l'ADN, és un procés on s'assigna una seqüència específica de bases a cada cadena de tal manera que s'associï en la conformació desitjada. La majoria de mètodes busquen dissenyar una seqüència que tingui la mínima energia termodinàmica. Les estructures mal ensamblades tenen una energia superior i, per tant, són més desfavorables. Això està fet segons mètodes heurístics tals com ara la minimització de simetria de la seqüència i la teoria basada en l'apropament de la codificació, o bé utilitzant de manera explícita un aparellament de bases termodinàmic. Els models geomètrics també s'usen per a examinar les estructures terciàries de les nanoestructures i assegurar així que els complexos no estan sobretensionats. [4][8]
El disseny d'àcid nucleics té un objectiu similar al disseny de proteïnes: en ambdós casos, la seqüència de monòmers és dissenyada per afavorir un plegament desitjat o una estructura associada i per a desafavorir altres estructures. El disseny d'àcids nucleics té l'avantatge de ser un problema de programació molt més simple, ja que la simplicitat del sistema d'aparellament de bases de Watson-Crick comporta a simples mètodes heurístics que produeixen dissenys experimentals robustos. De totes maneres les estructures d'ADN són menys versàtils que les de proteïnes quant a funcionalitat. [8]
Nanotecnologia de l'ADN estructural[modifica]
La nanotecnologia de l'ADN estructural, a vegades abreviada com NAE o bé SDN (de l'anglès: Structural DNA nanotechnology), se centra a sintetitzar i caracteritzar complexos d'àcids nucleics i els seus materials amb diverses estructures a nanoescala. La nanotecnologia de l'ADN estructural està basada en el fet que les estructures tridimensionals d'ADN- l'àcid nucleic de doble hèlix- té una geometria robusta i molt definida que fa que sigui possible preveure i dissenyar estructures de molècules d'ADN més complexes. Moltes d'aquestes estructures han estat creades formant dues i tres dimensions, així com estructures periòdiques, aperiòdiques i discretes.[9]
Entramats periòdics[modifica]

Els assemblatges de petits àcids nucleics poden ser dotats d'extrems enganxosos per a combinar-los en una estructura bidimensional de dos entramats periòdics. El primer exemple d'això fou la sèrie del DX o molècula amb doble encreuament. Cada DX pot estar designat amb quatre extrems enganxosos, un a cada final dels dominis de la doble hèlix, i aquests extrems enganxosos poden ser dissenyats amb seqüències que fan que les unitats de DX es combinin segons un patró tessel·lat. D'aquesta manera formen extensions de fulla plana, com a cristalls rígids en dos dimensions d'ADN. [11][12]
Algunes matrius bidimensionals han estat sintetitzades a partir d'altres patrons com per exemple la matriu de la unió de Holliday en forma de rombe[13] o bé diverses sèries basades en DX que utilitzen l'esquema de la doble cohesió. [14][15]
La creació d'un entramat de 3 dimensions a partir de l'ADN va ser un dels primers objectius de la nanotecnologia de l'ADN, però ha demostrat ser una de les més difícils de realitzar. No es va poder fer fins a l'any 2009 usant un motiu basat en el concepte de la tensegritat, un equilibri entre la tensió i la compressió de forces. [16]
Nanotubs[modifica]
A part de les fulles planes, les sèries de DX també es poden fer a partir de nanotubs buits de 4-20 nanòmetres de diàmetre. Aquests nanotubs d'ADN són d'alguna manera similars, en forma i mida als nanotubs de carboni, tot i que aquests últims són més forts i millors conductors, metre que els nanotubs d'ADN són més fàcilment modificables i connectables a altres estructures. Hi ha hagut múltiples esquemes de construcció de nanotubs d'ADN un dels quals utilitza la curvatura inherent de les rajoles de DX per a formar entramats DX que s'enrosquen sobre ells mateixos i es tanquen en forma de tub. [17] Un disseny alternatiu utilitza rajoles de cadena simple pels quals la rigidesa del tub és una propietat emergent. Aquest mètode també té l'avantatge que és capaç de determinar la circumferència del nanotub d'una forma senzilla i modular. [18]
Poliedra[modifica]
S'ha creat un nombre de molècules d'ADN de tres dimensions que tenen la connectivitat d'un poliedre com ara un cub o un octaedre. En altres paraules els dúplex d'ADN tracen les arestes d'un poliedre amb un encreuament d'ADN en cada vèrtex. Les primeres manifestacions d'ADN poliedra involucraven múltiples molècules d'ADN lligassa i en síntesi de fase sòlida en els passos per a crear poliedres concatenats. [19] Treballs més recents han estipulat que la síntesi de poliedra és molt més senzilla. Això inclou l'octaedre d'ADN creat a partir d'una llarga cadena única dissenyada per a plegar-se en la conformació correcta, [20] així com un tetraedre que pot estar produït per quatre cadenes d'ADN en un pas senzill. [1]
Formes arbitràries[modifica]

Les nanoestructures de formes arbitràries normalment es construeixen seguint el mètode d'origami de l'ADN. L'origami d'ADN fa ús d'una llarga cadena vírica com a cadena "bastida", i per mètode computacional dissenya cadenes "grapa" més curtes que s'uneixen a porcions de la cadena "bastida" i la forcen a adquirir la forma desitjada. Aquest mètode ofereix facilitat de disseny, ja que la seqüència d'àcids nucleics ve predeterminada per la seqüència de la cadena "bastida", i aquesta no requereix un alt percentatge de puresa ni una estequiometria adequada, a diferència de la majoria dels altres mètodes de nanotecnologia del adn. L'origami d'ADN va ser demostrat primerament per a formes bidimensionals; altres dissenys posteriors incloïen la cara somrient o smileyface i un mapa de l'Amèrica del Nord.[6] Més tard, el disseny es va estendre a formes tridimensionals sòlides.[21]
Les estructures han estat construïdes amb cares bidimensionals que es pleguen en una forma global tridimensional, similar a la d'una caixa de cartró. Aquestes poden ésser programades per obrir-se i alliberar el seu contingut en resposta a estímuls, propietat que les fa potencialment útils en el camp de l'encapsulació molecular programable. [22][23]
Nanoestructures funcionals dels àcids nucleics[modifica]
La nanotecnologia de l'ADN se centra en la creació de molècules de funcionalitat i estructura preestablerta. La funcionalitat dinàmica inclou, tant l'acció de les molècules sobre la mateixa estructura de l'àcid nucleic –per exemple, mitjançant la computació i el moviment mecànic-, com la inclusió de nanopartícules amb funcions pròpies dins d'altres molècules. Fins ara s'han trobat molts tipus de sistemes funcionals.
Nanoarquitectura[modifica]
Nadrian Seeman va suggerir, per primera vegada l'any 1987, [24] la possibilitat d'utilitzar matrius d'adn com a plantilla per a l'acoblament d'altres molècules funcionals, però no ha estat fins a èpoques més recents que aquests projectes s'han portat a la pràctica. L'any 2006, un grup d'investigadors uniren covalentment nanopartícules d'or a una rajola de DX i mostraren que l'autoacoblament d'estructures d'ADN implicava l'acoblament de les partícules unides a l'ADN. [25] També aquell any, Dwyer i LaBean demostraren les lletres “D”, “N” i “A” construïdes sobre una matriu de DX 4X4 emprant estreptavidina; [26] treballant amb el mateix enfocament, també provaren un acoblament jeràrquic a escales majors (8X8 i 8,96 MD). [27] El 2007 es va mostrar un projecte d'allotjament no covalent, basat en l'ús de poliamides de Dervan sobre una matriu de DX per ordenar les proteïnes d'estreptavidina segons tipus específics de rajoles en la matriu de DNA. [28]
També s'ha mostrat un gran interès en l'ús de la nanotecnologia de l'ADN per acoblar dispositius electrònics a escala molecular. Amb aquesta finalitat, l'ADN ha estat emprat per acoblar nanotubs de carboni de paret única a transistors d'efecte camp. [29]
Autoacoblament algorítmic[modifica]


La nanotecnologia de l'ADN ha estat aplicada al camp vinculat a la computació basada en l'ADN. Es poden escollir les seqüències finals d'unió de les rajoles DX, de manera que actuen com a rajoles de Wang i poden ser emprades en computació. S'han provat sèries DX l'acoblament de les quals codifica per a una disjunció exclusiva; això permet a la matriu d'ADN executar un autòmat cel·lular que genera un fractal anomenat triangle de Sierpinski. [30] Un altre sistema treballa com a comptador binari, mostrant una representació de nombres binaris en ordre creixent. Aquests resultats mostren que la computació pot ésser incorporada a l'acoblament de matrius de DNA, incrementant el seu abast més enllà de simples arranjaments periòdics.[31]
Cal fer notar que la computació basada en l'ADN se superposa a la nanotecnologia de l'ADN, tot i ser diferents. Aquesta última utilitza l'especificitat de la complementarietat de bases de Watson i Crick per construir noves estructures d'ADN. Aquestes poden ser emprades per a la computació basada en l'ADN, encara que no necessàriament. A més, es pot dur a terme la computació de l'ADN sense necessitat d'utilitzar les classes de molècules produïdes per la nanotecnologia.
Dispositius nanomecànics[modifica]
S'han construït els complexos d'ADN de manera que canvien la seva conformació com a resposta a algun estímul. Aquests tenen aplicacions en nanorobòtica. També s'han dissenyat màquines d'ADN que ofereixen moviment de torsió. El primer dispositiu d'aquesta classe utilitzava la transició entre les formes B-ADN i Z-ADN com a resposta a un canvi en les condicions d'amortiment. [32] Aquesta dependència de les condicions d'amortiment, però, provocava que tots els dispositius canviessin d'estat simultàniament. Un sistema posterior, anomenat “pinces moleculars”, canviava d'un estat obert a un tancat basant-se en la presència de cadenes control, permetent la manipulació individual de múltiples dispositius en solució. [33] A aquest sistema el seguiria un altre fonamentat en la presència de cadenes control encarregades de passar d'una conformació paranemic-crossover (PX) a una conformació de doble unió (JX2). [34]
S'han construït nanomàquines d'àcids nucleics que ofereixen moviment direccional al llarg d'una via lineal, anomenades ADN walkers.[35] En aquest camp, un gran nombre d'estratègies emprades per a automatitzar i controlar el moviment de l'ADN walker d'han dut a terme. Una de les estratègies emprades per a controlar el moviment dels ADN walkers al llarg de la pista, és la incorporació de cadenes control que han d'ésser afegides manualment com a seqüència.[36][37] Una altra proposta es basa en l'ús d'enzims de restricció o d'ADN catalític per trencar les cadenes i provocar el moviment endavant del walker, que és capaç d'avançar autònomament.[38][39] Un últim sistema proposava el moviment dels ADN walkers en una superfície bidimensional, en lloc de la via lineal individual, i demostrava la capacitat d'agafar i moure selectivament molècules cargo.[40] D'altra banda, s'ha provat un walker lineal que dur a terme la síntesi de la plantilla de l'ADN, possibilitant, així, la síntesi química autònoma dirigida pel walker.[41]
Aplicacions[modifica]
La nanotecnologia de l'ADN proporciona un dels pocs mètodes per dissenyar estructures complexes amb precisió a escala nanomètrica. El camp comença a descobrir aplicacions per solucionar problemes científics bàsics en biologia estructural i biofísica. Una d'aquestes aplicacions fa referència a la cristal·lografia, on les molècules difícilment cristal·litzen per elles mateixes i on, aplicant la nanotecnologia, podrien ser organitzades i orientades en un entramat tridimensional d'àcids nucleics, permetent la caracterització de la seva estructura. L'origami d'ADN també ha estat emprat per substituir cristall líquid en experiments d'acoblament dipolar residual en espectroscòpia mitjançant ressonància magnètica de proteïnes; la utilització de l'origami d'ADN constitueix un avantatge perquè, a diferència dels cristalls líquids, aquests són tolerants als detergents necessaris per a la suspensió de proteïnes de membrana a la solució. S'ha demostrat que l'ADN walker pot ser emprat a escala nanomètrica en la producció en cadena per moure nanopartícules i dirigir la síntesi química. A més a més, les estructures d'origami de DNA han estat summament útils en els estudis biofísics sobre funció enzimàtica i plegament proteic.[9][42]
La nanotecnologia de l'ADN té un elevat potencial en aplicacions del dia a dia. Es creu que la capacitat dels àcids nucleics d'organitzar altres molècules pot ser molt útil en l'electrònica a escala molecular: l'acoblament d'un entramat d'àcids nucleics pot servir de plantilla per a l'acoblament d'elements d'electrònica molecular tals com cables electrònics.[9] La nanotecnologia de l'ADN ha estat qualificada d'un tipus de matèria programable degut a l'ús de la computació en les propietats materials.[43]
També existeixen potencials aplicacions de la nanotecnologia de lADN en la branca de la nanomedicina: s'utilitza la computació en format biocompatible per fabricar “fàrmacs intel·ligents” per a l'administració de fàrmacs dirigits. S'està investigant un sistema tal com aquest que utilitza una capsa buida d'ADN contenidora de proteïnes que indueixen l'apoptosi o mort cel·lular, i que únicament s'obre en les proximitats més immediates d'una cèl·lula cancerosa.[42][44]
Materials i mètodes[modifica]
Les seqüències de les cadenes individuals d'ADN que serveixen per construir i acoblar les estructures diana són dissenyades mitjançant el mètode computacional, emprant simulació molecular i software de simulació termodinàmica. Una vegada les seqüències han estat dissenyades, les molècules d'àcid nucleic són sintetitzades mitjançant mètodes estàndards de síntesi d'oligonucleòtids. Aquest procés és automàtic si s'empra una màquina anomenada sintetitzador d'oligonucleòtids, i els àcids nucleics de seqüència personalitzada estan disponibles comercialment.[45] Per a mètodes que necessiten cadenes pures de concentració coneguda, les cadenes d'àcid nucleic poden ser purificades mitjançant electroforesi en gel desnaturalitzant;[46] les concentracions venen determinades per un dels mètodes de quantificació d'àcids nucleics utilitzant espectroscòpia d'absorbància ultraviolada.[47]
Les estructures objectiu plenament formades es caracteritzen per electroforesi en gel nadiu, el qual proveeix informació sobre les dimensions i la forma de les molècules d'ADN. Un assaig de canvi en la correguda electroforètica pot indicar si l'estructura incorpora totes les cadenes individuals desitjades.[48] El marcatge fluorescent i la transferència d'energia de ressonància de Förster (FRET) també s'empren per caracteritzar l'estructura de les molècules.[49]
Les estructures d'àcids nucleics es poden visualitzar per microscòpia de forces atòmiques, una tècnica molt adequada per a estructures bidimensionals, però no aplicable a les tridimensionals a causa de la interacció que s'estableix entre l'objectiu del microscopi i la fràgil estructura dels àcids nucleics. Per a aquestes estructures s'utilitzen la microscòpia electrònica de transmissió i la criomicroscòpia electrònica. Els entramats tridimensionals de gran extensió són analitzats mitjançant cristal·lografia de raigs X.[50][51]
Història[modifica]

Nadrian Seeman ideà el concepte de nanotecnologia de l'ADN a començaments de la dècada dels vuitanta. [52] Originalment, Seeman es referia a un entramat tridimensional d'ADN per orientar molècules diana, una tècnica que havia de simplificar l'estudi cristal·logràfic mitjançant l'eliminació del complex procés d'obtenció de cristalls purs. Es creu que l'origen d'aquesta idea data de la tardor de 1980, quan Seeman s'adonà de les similituds entre Depth, un gravat en fusta de l'artista M. C. Escher, i un conjunt d'unions de sis braços de DNA. [3][53]
Amb aquest objectiu, el 1991 el laboratori de Seeman publicava la síntesi d'un cub d'ADN, el primer objecte tridimensional construït a escala nanomètrica, i mereixedor del FeynmanPrize in Nanotechnology de l'any 1995. A aquest el va seguir un octaedre truncat. No obstant això, aviat es va veure que aquestes molècules, unes figures poligonals amb unions flexibles als seus vèrtexs, no eren suficientment rígides per formar entramats tridimensionals de gran extensió. Seguidament, Seeman va desenvolupar el motiu estructural més rígid de doble creuament (DX) i, en col·laboració amb Erik Winfree, el 1998 va publicar la creació d'un entramat bidimensional de DX.[3][52][54] L'any 2009, gairebé nou anys després d'iniciar els experiments, Seemanpublicava la síntesi d'un entramat tridimensional.[42]
Aquest tipus d'estructura basada en rajoles tenia l'avantatge que permetia la implementació de la computació basada en l'ADN, una tècnica que havia estat demostrada el 2004 per Winfree i Paul Rothemund en el seu informe sobre l'autoensamblatge algorítmic d'una estructura de Sierpinski, el qual els va fer mereixedors del FeynmanPrize in Nanotechnology de 2006. Segons el punt de vista de Winfree, les rajoles DX podien ser emprades com a rajoles de Wang, fet que implicava que el seu ensamblatge permetés l'aplicació de la computació.[52]
El 1999 Seeman dissenyà la primera màquina de l'ADN, capaç de canviar l'estructura d'aquest últim. Un any més tard Bernard Yuke demostraria teòricament un sistema millorat i que es convertiria en el primer dispositiu per àcids nucleics en fer ús del desplaçament de cadena mediat per punts de suport. El següent progrés va implicar traduir la demostració de Yuke en moviment mecànic; els anys 2004 i 2005, els equips de Seeman, NilesPierce, Andrew Turberfield i Chengde Mao demostrarien diversos sistemes d'ADN walker.[35]
El 2006 Rothemund presentà per primer cop la tècnica de l'origami d'ADN, que permetia crear molècules d'ADN plegades de qualsevol forma d'una manera fàcil i rígida. Rothemund havia concebut conceptualment aquest mètode com a pont d'unió entre els entramats DX de Seeman, que emprava moltes cadenes curtes, i l'octaedre d'ADN de William Shih, que consistia eminentment en una única cadena molt llarga; l'origami d'ADN de Rothemund contenia una cadena llarga el plegament de la qual era facilitat per diverses cadenes curtes. Aquest mètode va permetre la creació d'estructures molt més llargues del que abans era possible i tècnicament menys complexes de dissenyar i sintetitzar.[54] L'origami de l'ADN va ser l'article de portada de la revista Nature en l'edició del 15 de març de 2006.[6] A la recerca de Rothemund per demostrar les estructures bidimensionals de l'origami de l'ADN, va seguir la demostració de l'origami de l'ADN sòlid i tridimensional a càrrec de Shih el 2009, mentre que els laboratoris de Jørgen Kjems i HaoYan van demostrar estructures tridimensionals buides construïdes a partir de cares bidimensionals.[42]
Inicialment, la nanotecnologia de l'ADN, com a camp científic, va haver d'enfrontar-se amb cert escepticisme atesa la inusual absència d'ús biològic dels àcids nucleics com a material per construir estructures i realitzar computació, a més a més de la preponderància dels experiments de prova de concepte que estenien les capacitats dels camps però que estaven lluny de les aplicacions actuals. L'article transcendental de Seeman de 1991 sobre la síntesi de cubs d'ADN va ser rebutjat per la revista Science després que un crític l'elogiés per la seva originalitat i un altre el critiqués per falta de rellevància en termes de biologia. Tot i això, es considera que, a principis de 2010, el camp havia crescut fins al punt que les aplicacions per a la recerca en ciències bàsiques començaven a fer-se realitat, i les aplicacions pràctiques en medicina i altres camps començaven a ésser considerades factibles.[42][55] A més, el camp va créixer des d'un nombre molt baix de laboratoris i de reduïda activitat el 2001, a gairebé 60 el 2010, fet que incrementà substancialment el nombre d'avenços en el camp de la nanotecnologia al llarg de la dècada.[56]
Vegeu també[modifica]
Referències[modifica]
- ↑ 1,0 1,1 DNA polyhedra: Goodman, R.P.; Schaap, I.A.T.; Tardin, C.F.; Erben, C.M.; Berry, R.M.; Schmidt, C.F.; Turberfield, A.J. «Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication». Science, 310, 5754, 9 December 2005, pàg. 1661–1665. Bibcode: 2005Sci...310.1661G. DOI: 10.1126/science.1120367. PMID: 16339440.
- ↑ 2,0 2,1 Overview: Mao, Chengde «The Emergence of Complexity: Lessons from DNA». PLoS Biology, 2, 12, desembre 2004, pàg. 2036–2038. DOI: 10.1371/journal.pbio.0020431. PMC: 535573. PMID: 15597116.
- ↑ 3,0 3,1 3,2 3,3 3,4 Overview: Seeman, Nadrian C. «Nanotechnology and the double helix». Scientific American, 290, 6, juny 2004, pàg. 64–75. DOI: 10.1038/scientificamerican0604-64. PMID: 15195395.
- ↑ 4,0 4,1 Sequence design: Brenneman, Arwen; Condon, Anne «Strand design for biomolecular computation». Theoretical Computer Science, 287, 2002, pàg. 39. DOI: 10.1016/S0304-3975(02)00135-4.
- ↑ Overview: Lin, Chenxiang; Liu, Yan; Rinker, Sherri; Yan, Hao «DNA Tile Based Self-Assembly: Building Complex Nanoarchitectures». ChemPhysChem, 7, 8, 2006, pàg. 1641–7. DOI: 10.1002/cphc.200600260. PMID: 16832805.
- ↑ 6,0 6,1 6,2 DNA origami: Rothemund, Paul W. K. «Folding DNA to create nanoscale shapes and patterns». Nature, 440, 7082, 2006, pàg. 297–302. Bibcode: 2006Natur.440..297R. DOI: 10.1038/nature04586. PMID: 16541064.
- ↑ Kinetic assembly: Yin, Peng; Choi, Harry M. T.; Calvert, Colby R.; Pierce, Niles A. «Programming biomolecular self-assembly pathways». Nature, 451, 7176, 2008, pàg. 318–22. Bibcode: 2008Natur.451..318Y. DOI: 10.1038/nature06451. PMID: 18202654.
- ↑ 8,0 8,1 Sequence design: Dirks, Robert M.; Lin, Milo; Winfree, Erik & Pierce, Niles A. «Paradigms for computational nucleic acid design». Nucleic Acids Research, 32, 4, 2004, pàg. 1392–1403. DOI: 10.1093/nar/gkh291. PMC: 390280. PMID: 14990744.
- ↑ 9,0 9,1 9,2 Structural DNA nanotechnology: Seeman, Nadrian C. «An Overview of Structural DNA Nanotechnology». Molecular Biotechnology, 37, 3, 2007, pàg. 246–57. DOI: 10.1007/s12033-007-0059-4. PMID: 17952671.
- ↑ Other arrays: Strong, Michael «Protein Nanomachines». PLoS Biology, 2, 3, 2004, pàg. e73. DOI: 10.1371/journal.pbio.0020073. PMC: 368168. PMID: 15024422.
- ↑ DX arrays: Winfree, Erik; Liu, Furong; Wenzler, Lisa A. & Seeman, Nadrian C. «Design and self-assembly of two-dimensional DNA crystals». Nature, 394, 6693, 6 August 1998, pàg. 529–544. Bibcode: 1998Natur.394..539W. DOI: 10.1038/28998. PMID: 9707114.
- ↑ DX arrays: Liu, Furong; Sha, Ruojie & Seeman, Nadrian C. «Modifying the Surface Features of Two-Dimensional DNA Crystals». Journal of the American Chemical Society, 121, 5, 10 February 1999, pàg. 917–922. DOI: 10.1021/ja982824a.
- ↑ Other arrays: Mao, Chengde; Sun, Weiqiong & Seeman, Nadrian C. «Designed Two-Dimensional DNA Holliday Junction Arrays Visualized by Atomic Force Microscopy». Journal of the American Chemical Society, 121, 23, 16 June 1999, pàg. 5437–5443. DOI: 10.1021/ja9900398.
- ↑ Other arrays: Constantinou, Pamela E.; Wang, Tong; Kopatsch, Jens; Israel, Lisa B.; Zhang, Xiaoping; Ding, Baoquan; Sherman, William B.; Wang, Xing; Zheng, Jianping; Sha, Ruojie & Seeman, Nadrian C. «Double cohesion in structural DNA nanotechnology». Organic and Biomolecular Chemistry, 4, 18, 2006, pàg. 3414–3419. DOI: 10.1039/b605212f. PMID: 17036134.
- ↑ Other arrays: Mathieu, Frederick; Liao, Shiping; Kopatsch, Jens; Wang, Tong; Mao, Chengde & Seeman, Nadrian C. «Six-Helix Bundles Designed from DNA». Nano Letters, 5, 4, abril 2005, pàg. 661–665. Bibcode: 2005NanoL...5..661M. DOI: 10.1021/nl050084f. PMID: 15826105.
- ↑ Three-dimensional arrays: Zheng, Jianping; Birktoft, Jens J.; Chen, Yi; Wang, Tong; Sha, Ruojie; Constantinou, Pamela E.; Ginell, Stephan L.; Mao, Chengde; Seeman, Nadrian C. «From Molecular to Macroscopic via the Rational Design of a Self-Assembled 3D DNA Crystal». Nature, 461, 7260, 2009, pàg. 74–7. Bibcode: 2009Natur.461...74Z. DOI: 10.1038/nature08274. PMC: 2764300. PMID: 19727196.
- ↑ DNA nanotubes: Rothemund, Paul W. K.; Ekani-Nkodo, Axel; Papadakis, Nick; Kumar, Ashish; Fygenson, Deborah Kuchnir & Winfree, Erik «Design and Characterization of Programmable DNA Nanotubes». Journal of the American Chemical Society, 126, 50, 22 December 2004, pàg. 16344–16352. DOI: 10.1021/ja044319l. PMID: 15600335.
- ↑ DNA nanotubes: Yin, P.; Hariadi, R. F.; Sahu, S.; Choi, H. M. T.; Park, S. H.; Labean, T. H.; Reif, J. H. «Programming DNA Tube Circumferences». Science, 321, 5890, 2008, pàg. 824–826. Bibcode: 2008Sci...321..824Y. DOI: 10.1126/science.1157312. PMID: 18687961.
- ↑ DNA polyhedra: Zhang, Yuwen; Seeman, Nadrian C. «Construction of a DNA-truncated octahedron». Journal of the American Chemical Society, 116, 5, 1994, pàg. 1661–1669. DOI: 10.1021/ja00084a006.
- ↑ DNA polyhedra: Shih, William M.; Quispe, Joel D.; Joyce, Gerald F. «A 1.7-kilobase single-stranded DNA that folds into a nanoscale octahedron». Nature, 427, 6975, 12 February 2004, pàg. 618–621. DOI: 10.1038/nature02307. PMID: 14961116.
- ↑ DNA origami: Douglas, Shawn M.; Dietz, Hendrik; Liedl, Tim; Högberg, Björn; Graf, Franziska; Shih, William M. «Self-assembly of DNA into nanoscale three-dimensional shapes». Nature, 459, 7245, 2009, pàg. 414–418. Bibcode: 2009Natur.459..414D. DOI: 10.1038/nature08016. PMC: 2688462. PMID: 19458720.
- ↑ DNA boxes: Andersen, Ebbe S.; Dong, Mingdong; Nielsen, Morten M.; Jahn, Kasper; Subramani, Ramesh; Mamdouh, Wael; Golas, Monika M.; Sander, Bjoern; Stark, Holger «Self-assembly of a nanoscale DNA box with a controllable lid». Nature, 459, 7243, 2009, pàg. 73–6. Bibcode: 2009Natur.459...73A. DOI: 10.1038/nature07971. PMID: 19424153.
- ↑ DNA boxes: Ke, Yonggang; Sharma, Jaswinder; Liu, Minghui; Jahn, Kasper; Liu, Yan; Yan, Hao «Scaffolded DNA Origami of a DNA Tetrahedron Molecular Container». Nano Letters, 9, 6, 2009, pàg. 2445–7. Bibcode: 2009NanoL...9.2445K. DOI: 10.1021/nl901165f. PMID: 19419184.
- ↑ Nanoarchitecture: Robinson, Bruche H.; Seeman, Nadrian C. «The Design of a Biochip: A Self-Assembling Molecular-Scale Memory Device». Protein Engineering, 1, 4, agost 1987, pàg. 295–300. DOI: 10.1093/protein/1.4.295. PMID: 3508280.
- ↑ Nanoarchitecture: Zheng, Jiwen; Constantinou, Pamela E.; Micheel, Christine; Alivisatos, A. Paul; Kiehl, Richard A. & Seeman Nadrian C. «2D Nanoparticle Arrays Show the Organizational Power of Robust DNA Motifs». Nano Letters, 6, 7, 2006, pàg. 1502–1504. Bibcode: 2006NanoL...6.1502Z. DOI: 10.1021/nl060994c. PMID: 16834438.
- ↑ Nanoarchitecture: Park, Sung Ha; Sung Ha Park, Constantin Pistol, Sang Jung Ahn, John H. Reif, Alvin R. Lebeck, Chris Dwyer, Thomas H. LaBean «Finite-Size, Fully Addressable DNA Tile Lattices Formed by Hierarchical Assembly Procedures». Angewandte Chemie, 118, 40, October 2006, pàg. 749–753. DOI: 10.1002/ange.200690141.
- ↑ Nanoarchitecture: Pistol, Constantin; Constantin Pistol, Chris Dwyer «Scalable, Low-cost, Hierarchical Assembly of Programmable DNA Nanostructures». Nanotechnology, 18, 12, March 2007, pàg. 125305–9. Bibcode: 2007Nanot..18l5305P. DOI: 10.1088/0957-4484/18/12/125305.
- ↑ Nanoarchitecture: Cohen, Justin D.; Sadowski, John P.; Dervan, Peter B. «Addressing Single Molecules on DNA Nanostructures». Angewandte Chemie, 46, 42, 2007, pàg. 7956–7959. DOI: 10.1002/anie.200702767. PMID: 17763481.
- ↑ Nanoarchitecture: Maune, Hareem T.; Han, Si-Ping; Barish, Robert D.; Bockrath, Marc; Iii, William A. Goddard; Rothemund, Paul W. K.; Winfree, Erik «Self-assembly of carbon nanotubes into two-dimensional geometries using DNA origami templates». Nature Nanotechnology, 5, 1, 2009, pàg. 61–6. Bibcode: 2010NatNa...5...61M. DOI: 10.1038/nnano.2009.311. PMID: 19898497.
- ↑ 30,0 30,1 Algorithmic self-assembly: Rothemund, Paul W. K.; Papadakis, Nick & Winfree, Erik «Algorithmic Self-Assembly of DNA Sierpinski Triangles». PLoS Biology, 2, 12, desembre 2004, pàg. 2041–2053. DOI: 10.1371/journal.pbio.0020424. PMC: 534809. PMID: 15583715.
- ↑ Algorithmic self-assembly: Barish, Robert D.; Rothemund, Paul W. K.; Winfree, Erik «Two Computational Primitives for Algorithmic Self-Assembly: Copying and Counting». Nano Letters, 5, 12, 2005, pàg. 2586–2592. Bibcode: 2005NanoL...5.2586B. DOI: 10.1021/nl052038l. PMID: 16351220.
- ↑ DNA machines: Mao, Chengde; Sun, Weiqiong; Shen, Zhiyong & Seeman, Nadrian C. «A DNA Nanomechanical Device Based on the B-Z Transition». Nature, 397, 6715, 14 January 1999, pàg. 144–146. Bibcode: 1999Natur.397..144M. DOI: 10.1038/16437. PMID: 9923675.
- ↑ DNA machines: Yurke, Bernard; Turberfield, Andrew J.; Mills, Allen P., Jr; Simmel, Friedrich C. & Neumann, Jennifer L. «A DNA-fuelled molecular machine made of DNA». Nature, 406, 6796, 10 August 2000, pàg. 605–609. Bibcode: 2000Natur.406..605Y. DOI: 10.1038/35020524. PMID: 10949296.
- ↑ DNA machines: Yan, Hao; Zhang, Xiaoping; Shen, Zhiyong & Seeman, Nadrian C. «A robust DNA mechanical device controlled by hybridization topology». Nature, 415, 6867, 3 January 2002, pàg. 62–65. Bibcode: 2002Natur.415...62Y. DOI: 10.1038/415062a. PMID: 11780115.
- ↑ 35,0 35,1 DNA machines: Bath, Jonathan; Turberfield, Andrew J. «DNA nanomachines». Nature Nanotechnology, 2, 5, 2007, pàg. 275–284. Bibcode: 2007NatNa...2..275B. DOI: 10.1038/nnano.2007.104. PMID: 18654284.
- ↑ DNA walkers: Shin, JS; Pierce, NA «A synthetic DNA walker for molecular transport». Journal of the American Chemical Society, 126, 35, 2004, pàg. 10834–5. DOI: 10.1021/ja047543j. PMID: 15339155.
- ↑ DNA walkers: Sherman, William B.; Seeman, Nadrian C. «A Precisely Controlled DNA Biped Walking Device». Nano Letters, 4, 7, 2004, pàg. 1203–1207. Bibcode: 2004NanoL...4.1203S. DOI: 10.1021/nl049527q.
- ↑ DNA walkers: Tian, Ye; He, Yu; Chen, Yi; Yin, Peng; Mao, Chengde «A DNAzyme That Walks Processively and Autonomously along a One-Dimensional Track». Angewandte Chemie, 117, 28, 2005, pàg. 4429–4432. DOI: 10.1002/ange.200500703.
- ↑ DNA walkers: Bath, Jonathan; Green, Simon J.; Turberfield, Andrew J. «A Free-Running DNA Motor Powered by a Nicking Enzyme». Angewandte Chemie International Edition, 44, 28, 2005, pàg. 4358–4361. DOI: 10.1002/anie.200501262.
- ↑ Functional DNA walkers: Lund, Kyle; Manzo, Anthony J.; Dabby, Nadine; Michelotti, Nicole; Johnson-Buck, Alexander; Nangreave, Jeanette; Taylor, Steven; Pei, Renjun; Stojanovic, Milan N. «Molecular Robots Guided by Prescriptive Landscapes». Nature, 465, 7295, 2010, pàg. 206–210. Bibcode: 2010Natur.465..206L. DOI: 10.1038/nature09012. PMC: 2907518. PMID: 20463735.
- ↑ Functional DNA walkers: He, Yu; Liu, David R. «Autonomous Multistep Organic Synthesis in a Single Isothermal Solution Mediated by a DNA Walker». Nature Nanotechnology, 5, 11, 2010, pàg. 778–782. Bibcode: 2010NatNa...5..778H. DOI: 10.1038/nnano.2010.190. PMC: 2974042. PMID: 20935654.
- ↑ 42,0 42,1 42,2 42,3 42,4 History/applications: Service, Robert F. «DNA Nanotechnology Grows Up». Science, 332, 6034, 03-06-2011, pàg. 1140–1143. DOI: 10.1126/science.332.6034.1140.
- ↑ Applications: Rietman, Edward A. Molecular engineering of nanosystems. Springer, 2001, p. 209–212. ISBN 978-0-387-98988-4 [Consulta: 17 abril 2011].
- ↑ Applications: Jungmann, R; Renner, S; Simmel, FC «From DNA nanotechnology to synthetic biology». HFSP journal, 2, 2, 2008, pàg. 99–109. DOI: 10.2976/1.2896331. PMC: 2645571. PMID: 19404476.
- ↑ Methods: Ellington, A.; Pollard, J.D. «Synthesis and purification of oligonucleotides.». Current Protocols in Molecular Biology, 01-05-2001. DOI: 10.1002/0471142727.mb0211s42.
- ↑ Methods: Ellington, A.; Pollard, J.D «Purification of oligonucleotides using denaturing polyacrylamide gel electrophoresis.». Current Protocols in Molecular Biology doi= doi:10.1002/0471142727.mb0212s42, 01-05-2001.
- ↑ Methods: Gallagher, S. R.; Desjardins, P. «Quantitation of nucleic acids and proteins.». Current Protocols Essential Laboratory Techniques, 01-07-2011. DOI: 10.1002/9780470089941.et0202s5.
- ↑ Methods: Chory, J.; Pollard, J. D. «Separation of small DNA fragments by conventional gel electrophoresis.». Current Protocols in Molecular Biology., 1 maig 2001.. DOI: 10.1002/0471142727.mb0207s47.
- ↑ Methods: Walter, Nils G. «Probing RNA Structural Dynamics and Function by Fluorescence Resonance Energy Transfer (FRET)». Current Protocols, 01-02-2003. DOI: 10.1002/0471142700.nc1110s11.
- ↑ Methods: Lin, C.; Ke, Y. «Synthesis and Characterization of Self-Assembled DNA Nanostructures.». DNA Nanotechnology: Methods and Protocols. Methods in Molecular Biology, 749, 2011, pàg. 1–11. DOI: 10.1007/978-1-61779-142-0_1.
- ↑ Methods: Bloomfield, Victor A.; Crothers, Donald M., Tinoco, Jr., Ignacio. Nucleic acids: structures, properties, and functions. Sausalito, Calif: University Science Books, 2000, p. 84–86, 396–407. ISBN 0935702490.
- ↑ 52,0 52,1 52,2 History: Pelesko, John A. Self-assembly: the science of things that pu t thems elves together. Nova York: Chapman & Hall/CRC, 2007, p. 201, 242, 259. ISBN 978 1 58488 687 7.
- ↑ History: See Nadrian Seeman's homepage, Current crystallization protocol for a statement of the problem, and Nadrian Seeman's homepage, DNA cages containing oriented guests for the proposed solution.
- ↑ 54,0 54,1 DNA origami: Rothemund, Paul W. K.. «Scaffolded DNA Origami: from Generalized Multicrossovers to Polygonal Networks». A: Chen, Junghuei. Nanotechnology: Science and Computation. Nova York: Springer, 2006, p. 3–21 (Natural Computing Series). DOI 10.1007/3-540-30296-4_1. ISBN 978 3 540 30295 7.
- ↑ History: Hopkin, Karen «Profile: 3-D Seer». The Scientist, agost 2011 [Consulta: 8 agost 2011].
- ↑ History: Seeman, Nadrian «Structural DNA Nanotechnology: Growing Along with NanoLetters». Nano Letters, 10, 6, 2010, pàg. 1971–1978. Bibcode: 2010NanoL..10.1971S. DOI: 10.1021/nl101262u. PMC: 2901229. PMID: 20486672.
Bibliografia addicional[modifica]
La següent és una llista d'articles i llibres de referència que poden ser d'utilitat al lector interessat a aprofundir en el coneixement de la nanotecnologia de l'ADN.
- Seeman, Nadrian C. «Nanotechnology and the double helix». Scientific American, 290, 6, juny 2004, pàg. 64–75. DOI: 10.1038/scientificamerican0604-64. PMID: 15195395.—Article redactat pel fundador del camp de la nanotecnologia de l'ADN i dirigit a un públic ampli i no expert en la matèria
- Pelesko, John A. «Chapter 8: DNA Self-Assembly». A: Self-assembly: the science of things that put themselves together. Nova York: Chapman & Hall/CRC, 2007. ISBN 978 1 58488 687 7.—Visió general dels resultats del camp tractats des de la perspectiva de l'autoacoblament
- Seeman, Nadrian C. «An Overview of Structural DNA Nanotechnology». Molecular Biotechnology, 37, 3, 2007, pàg. 246–57. DOI: 10.1007/s12033-007-0059-4. PMID: 17952671.—Compendi que inclou resultats d'experiments antics
- Seeman, Nadrian «Structural DNA Nanotechnology: Growing Along with NanoLetters». Nano Letters, 10, 6, 2010, pàg. 1971–1978. Bibcode: 2010NanoL..10.1971S. DOI: 10.1021/nl101262u. PMC: 2901229. PMID: 20486672.—Sumari dels resultats més recents en el camp; període 2001-2010
- Feldkamp, Udo; Niemeyer, Christof M. «Rational Design of DNA Nanoarchitectures». Angewandte Chemie International Edition, 45, 12, 2006, pàg. 1856–76. DOI: 10.1002/anie.200502358. PMID: 16470892.—Article elaborat des del punt de vista del disseny de l'estructura secundària
- Lin, Chenxiang; Liu, Yan; Rinker, Sherri; Yan, Hao «DNA Tile Based Self-Assembly: Building Complex Nanoarchitectures». ChemPhysChem, 7, 8, 2006, pàg. 1641–7. DOI: 10.1002/cphc.200600260. PMID: 16832805.—Resum molt breu centrat específicament en l'acoblament basat en rajoles
- Bath, Jonathan; Turberfield, Andrew J. «DNA nanomachines». Nature Nanotechnology, 2, 5, 2007, pàg. 275–284. Bibcode: 2007NatNa...2..275B. DOI: 10.1038/nnano.2007.104. PMID: 18654284.—Compendi dels dispositius nanomècanics d'àcids nucleics
- Zhang, David Yu; Seelig, Georg «Dynamic DNA nanotechnology using strand-displacement reactions». Nature Chemistry, 3, 2, 2011, pàg. 103–113. Bibcode: 2011NatCh...3..103Z. DOI: 10.1038/nchem.957. PMID: 21258382.—Sumari dels sistemes d'ADN que fan ús de mecanismes de desplaçament de cadenes
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Nanotecnologia de l'ADN |
- International Society for Nanoscale Science, Computation and Engineering
- What is Bionanotechnology?—un vídeo introductori a la nanotecnologia de l'ADN