Reacció de deshidratació
- No s'ha de confondre amb la dessecació que és treure l'aigua dels solvents o reactius.
La reacció de deshidratació o la síntesi de deshidratació, també anomenada hidrogenació de Zimmer, en química o ciències biològiques, es defineix normalment com una reacció química que implica la pèrdua d'aigua per part de la molècula que reacciona. Les reaccions de deshidratació són un subgrup de les reaccions d'eliminació. Com que el grup hidroxil (OH) és un grup sortint pobre, tenir un àcid de Brønsted com catalitador sovint ajuda a protonatar el grup hidroxil per donar un grup sortint millor –OH₂+. La reacció inversa de la reacció de deshidratació, és la reacció d'hidratació.
Reaccions de deshidratació i reaccions de síntesi de deshidratació tenen el mateix significat i sovint es poden usar de manera intercanviable. Dos monosacàrids, com la glucosa i la fructosa, es poden unir (per formar la sacarosa) usant la síntesi de deshidratació. La nova molècula que consta de dos monosacàrids es diu un disacàrid.
El procés de la hidròlisi és la reacció inversa, osa que significa que l'aigua es recombina amb els grups hidroxil i el disacàrid torna a ser dos monosacàrids.
En la reacció de condensació, que hi està relacionada, l'aigua s'allibera des de dos reactius diferents.
Reaccions de deshidratació[modifica]
En la síntesi orgànica, hi ha molts exemples de reaccions de deshidratacó, per exemple ladeshidratació d'alcohols o dels sucres.
| Reacció | Equació | |
|---|---|---|
| Conversió d'alcohols a èters | 2 R-OH → R-O-R + H₂O | |
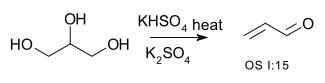
| Conversió d'alcohols a alquens | R-CH₂-CHOH-R → R-CH=CH-R + H₂O | per exemple la conversió del glicerol a acroleïna:[1]
o la deshidratació de 2-metil-1-ciclohexanol a (principalment) 1-metilciclohexà[2] |
| Conversió d'àcids carboxílics a àcids anhidres | 2 RCO₂H → (RCO)₂O + H₂O | |
| Conversió d'amides a nitrils | RCONH₂ → R-CN + H₂O | |
| rearranjament de dienol benzè | 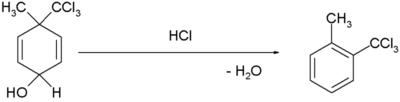 [3][4] [3][4]
| |
| Reaccions de deshidratació | ||
Algunes reaccions de deshidratació són mecànicament complexes, per exemple la reacció del sucre sacarosa amb àcid sulfúric concentrat[5] per formar carboni implica la formació d'enllaç carboni carboni.[6]
- C₁₂H22O11 + 98% àcid sulfúric → 12 C (escuma grafítica) + 11 H₂O vapor + mescla d'àcid sulfúric/aigua
La reacció anterior és fortament exotèrmica.[7]
Agents deshidratants comuns són:l'àcid sulfúric concentrat, l'àcid fosfòric concentrat, òxid d'alumini calent, ceràmica calenta.
Vegeu també[modifica]
Referències[modifica]
- ↑ Organic syntheses OS I:15 Link
- ↑ Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment J. Brent Friesen and Robert Schretzman J. Chem. Educ., 2011, 88 (8), pp 1141–1147 doi:10.1021/ed900049b
- ↑ H. Plieninger and Gunda Keilich «Die Dienol-Benzol-Umlagerung». Angew. Chem., 68, 19, 1956, pàg. 618–618. DOI: 10.1002/ange.19560681914.
- ↑ Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog, and E. B. Hershberg «The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione». J. Am. Chem. Soc., 80, 14, 1958, pàg. 3702–3705. DOI: 10.1021/ja01547a058.
- ↑ youtube clip reaction sugar with sulfuric acid
- ↑ http://www.exo.net/~pauld/activities/astronomy/transitvenus/sugarsulfuricacid.htm
- ↑ (Atenció aquesta reacció produeix un vaporque conté àcid sulfúric perillós i només es pot fer en instal·lacions especialment ben ventilades.)