Termodinàmica

La termodinàmica (del grec θερμo-, thérmë, que significa "calor"[1] i δύναμις, dynamis, que significa "força")[1] és la branca de la física i la química que estudia els efectes dels canvis de la temperatura, pressió i volum dels sistemes físics a un nivell macroscòpic. Aproximadament, calor significa "energia en trànsit" i dinàmica es refereix al "moviment", per la qual cosa, en essència, la termodinàmica estudia la circulació de l'energia i com l'energia infon moviment. Així, estudia els fenòmens físics relacionats amb la calor i la temperatura, és a dir, el moviment desordenat de les partícules que formen la matèria. Històricament, la termodinàmica es va desenvolupar a partir de la necessitat d'augmentar l'eficiència de les primeres màquines de vapor.
El punt de partida per a la major part de les consideracions termodinàmiques són les lleis de la termodinàmica, que postulen que l'energia pot ser intercanviada entre sistemes físics en forma de calor o treball. També es postula l'existència d'una magnitud anomenada entropia, que pot ser definida per a qualsevol sistema. A la termodinàmica s'estudien i classifiquen les interaccions entre diversos sistemes, fet que porta a definir conceptes com a sistema termodinàmic i el seu contorn. Un sistema termodinàmic es caracteritza per les seves propietats, relacionades entre si mitjançant les equacions d'estat. Aquestes es poden combinar per expressar l'energia interna i els potencials termodinàmics, útils per determinar les condicions d'equilibri entre sistemes i els processos espontanis.
Amb aquestes eines, la termodinàmica descriu com els sistemes responen als canvis en el seu entorn. Això es pot aplicar a una àmplia varietat de temes de ciència i enginyeria, tals com motors, transicions de fase, reaccions químiques, fenòmens de transport, i fins i tot forats negres. Els resultats de la termodinàmica són essencials per a altres camps de la física i la química, enginyeria química, enginyeria aeroespacial, enginyeria mecànica, biologia cel·lular, enginyeria biomèdica, i la ciència de materials per anomenar-ne alguns.
Història[modifica]

La història de la termodinàmica com a disciplina científica generalment comença amb Otto von Guericke que, el 1650, va construir i va dissenyar la primera bomba de buit del món i va demostrar l'existència del buit fent servir els seus hemisferis de Magdeburg. El que va portar Guericke a fer el buit va ser la idea de refutar la suposició feta per Aristòtil i acceptada durant molt de temps que 'la natura odia el buit'. Poc després que Guericke, el físic i farmacèutic irlandès Robert Boyle es va assabentar dels dissenys de Guericke i, el 1656, en coordinació amb el científic anglès Robert Hooke, varen construir una bomba d'aire.[2] Fent servir aquesta bomba, Boyle i Hooke van observar una correlació entre pressió, temperatura, i volum. Llavors van formular la Llei de Boyle, la qual estableix que la pressió i el volum són inversament proporcionals. El 1679, basant-se en aquests conceptes, un soci de Boyle anomenat Denis Papin va construir un digestor d'ossos, que era un recipient tancat amb un estretament on una tapadora amb un pes retenia el vapor fins que es generava una pressió prou alta i que servia per a extreure el greix dels ossos. Un giny precursor de l'autoclau i de l'olla de pressió domèstica.
En dissenys posteriors hi va implementar una vàlvula de seguretat que impedia que la màquina explotés. Mirant la vàlvula movent-se rítmicament amunt i avall, Papin va concebre la idea de l'èmbol i del cilindre de motor. Tanmateix no va desenvolupar el seu disseny. No obstant això, el 1697, basant-se en els dissenys de Papin, l'enginyer Thomas Savery va construir el primer motor, el seu exemple va ser seguit el 1712 per Thomas Newcomen. Encara que aquests primers motors eren molt ineficients, van atreure l'atenció dels principals científics de l'època.
Els conceptes fonamentals de capacitat calorífica i calor latent, que eren necessaris per al desenvolupament de la termodinàmica, van ser desenvolupats pel professor Joseph Black a la Universitat de Glasgow, on també treballava James Watt com a fabricant d'instruments. Watt va consultar Black per tal d'experimentar amb la seva màquina de vapor, però va ser Watt qui va concebre la idea d'un condensador de vapor extern que va comportar un gran augment de l'eficiència de la màquina de vapor. Sobre la base de tot el treball anterior, Sadi Carnot, considerat el "pare de la termodinàmica", va publicar el 1824 Reflections on the Motive Power of Fire (Reflexions sobre l'energia motiva del foc), un discurs sobre la calor, la potència, l'energia i l'eficiència dels motors. El document descriu les relacions energètiques bàsiques entre la màquina de Carnot, el cicle de Carnot i la força motriu. Això va marcar l'inici de la termodinàmica com a ciència moderna.[3]
El desenvolupament de la termodinàmica com a ciència es va iniciar a principis del segle xix a conseqüència de l'interès a millorar el rendiment de les màquines de vapor.[4] El terme termodinàmica va ser encunyat per James Joule el 1849 per designar la ciència de les relacions entre la calor i la potència.[3] La primera i la segona llei de la termodinàmica van sorgir simultàniament a la dècada del 1850, sobretot a partir de l'obra de William Rankine, Rudolf Clausius i William Thomson (Lord Kelvin).
El 1858, William Thomson va utilitzar el terme "thermo-dynamics" com a terme funcional a l'article titulat An Account of Carnot's Theory of the Motive Power of Heat.[5] El primer llibre de text de termodinàmica va ser escrit el 1859 per William Rankine, físic de formació i professor d'enginyeria civil i mecànica a la Universitat de Glasgow.[6]
Els fonaments de la termodinàmica estadística es van establir pels físics, com ara James Clerk Maxwell, Ludwig Boltzmann, Max Planck, Rudolf Clausius i Josiah Willard Gibbs.
Entre els anys 1873 i 1876 el físic i matemàtic nord-americà Josiah Willard Gibbs va publicar una sèrie de tres articles, essent els més famós el titulat On the Equilibrium of Heterogeneous Substances[7] (Sobre l'equilibri de les substàncies heterogènies, en els quals mostrava com els processos termodinàmics, entre els quals s'inclouen les reaccions químiques, podien ser analitzats gràficament, mitjançant l'estudi de l'energia, l'entropia, el volum específic, la temperatura i la pressió del sistema termodinàmic, d'aquesta manera hom pot determinar si un procés podria produir-se de manera espontània.[8]
Sistemes termodinàmics[modifica]

Un concepte important en termodinàmica és el "sistema". Tot el que hi ha a l'univers excepte el sistema es coneix com a entorn. Un sistema és la regió de l'univers objecte d'estudi. Un sistema està separat de la resta de l'univers per una frontera que pot ser imaginària o no, però que, per convenció, delimita un volum finit. Els intercanvis possibles de treball, calor, o matèria entre el sistema i l'entorn tenen lloc a través d'aquesta frontera. Les fronteres són de quatre tipus: fix, mòbil, real, i imaginari.
Bàsicament, la "frontera" és simplement una línia de punts imaginària dibuixada al voltant d'un volum d'alguna cosa en què hi haurà un intercanvi d'energia interna d'alguna cosa. Tot allò que passa a través de la frontera que efectua un canvi en l'energia interna de d'alguna cosa s'ha de tenir en compte en l'equació de balanç energètic. Aquest alguna cosa pot ser la regió volumètrica que envolta un únic àtom en un determinat estat d'energia ressonant, com Max Planck ho va definir el 1900; pot ser un volum de vapor o aire en una màquina de vapor, com Sadi Carnot el va definir el 1824; pot ser el cos d'un cicló tropical, com Kerry Emanuel teoritzava el 1986 en el camp de la termodinàmica atmosfèrica; també podria ser només un núclid (és a dir un sistema de quarks) tal com alguns estan teoritzant actualment en termodinàmica de quàntica.
Per a un motor, un límit fix significa que l'èmbol estigui fixat en la seva posició; com a tal, ocorre un procés de volum constant. En aquell mateix motor, un límit mòbil permet que l'èmbol es mogui entrant i sortint. Per a sistemes tancats, els límits són reals mentre per a sistemes obert els límits sovint són imaginaris. Hi ha cinc classes principals de sistemes:
- Sistemes Aïllats - la matèria i l'energia no poden travessar la frontera
- Sistemes Adiabàtics - la calor no pot travessar la frontera
- Sistemes Diatèrmics - la calor pot travessar la frontera
- Sistemes Tancats - la matèria pot no travessar la frontera
- Sistemes Oberts - la calor, treball, i la matèria poden travessar la frontera (en aquest cas sovint s'anomenen volum de control)
A mesura que passa el temps passa en un sistema aïllat, les diferències internes en el sistema tendeixen a equilibrar-se (forces, pressions, temperatures i diferències de densitat). Es considera que, un sistema en el qual tots els processos que s'equilibren ja han arribat pràcticament al final, és en estat d'equilibri termodinàmic.
En l'equilibri termodinàmic, les propietats d'un sistema són, per definició, invariables amb el temps. Els sistemes en l'equilibri són molt més simples i més fàcils d'entendre que els sistemes que no estan en l'equilibri. Sovint, en analitzar un procés termodinàmic, es pot suposar que cada estat intermedi en el procés està en equilibri. Això també simplifica considerablement la situació. Es diu que els processos termodinàmics que es desenvolupen tan lentament com per deixar que cada pas intermedi sigui un estat d'equilibri són processos reversibles.
Lleis de la termodinàmica[modifica]
Llei zero de la termodinàmica[modifica]
L'equilibri termodinàmic d'un sistema es defineix com la condició del sistema en el qual les variables empíriques utilitzades per definir un estat del sistema (pressió, volum, camp elèctric, polarització, magnetització, tensió lineal, tensió superficial, entre d'altres) han arribat a un punt d'equilibri i per tant no varien al llarg del temps, és a dir no són dependents del temps. Aquestes variables empíriques (experimentals) d'un sistema són conegudes com a coordenades termodinàmiques del sistema.
Aquest principi s'anomena de l'equilibri termodinàmic. Si dos sistemes A i B estan en equilibri termodinàmic, i B està en equilibri termodinàmic amb un tercer sistema C, llavors A i C estan al seu torn en equilibri termodinàmic. Aquest principi és fonamental, tot i ser àmpliament acceptat; no va ser formulat formalment fins després d'haver enunciat les altres tres lleis. D'aquí que rep la posició 0.
Aquesta llei implica que l'equilibri tèrmic és una relació d'equivalència i permet construir escales termomètriques. Es fa servir implícitament sempre que es fa una mesura de temperatura: Es posa un cos B anomenat termòmetre en contacte amb un cos A i un cop el termòmetre i el cos A han arribat a l'equilibri termodinàmic es fa servir una propietat del cos B (per exemple la densitat del mercuri o la conductivitat d'una resistència elèctrica) per llegir la temperatura. Si el mateix termòmetre es posa en contacte amb un altre cos C i dona la mateixa temperatura, aquest principi afirma que el cos A i el cos C estan a la mateixa temperatura sense necessitat de posar-los en contacte i observar si es produeixen canvis en les seves propietats o no.
La propietat del termòmetre que es fa servir per determinar la temperatura se'n diu propietat termomètrica i de la temperatura que es defineix fent servir una propietat termomètrica se'n diu temperatura empírica.[9]
Primera llei de la termodinàmica[modifica]
També conegut com a principi de conservació de l'energia per a la termodinàmica, estableix que si es realitza treball sobre un sistema o bé aquest intercanvia calor amb un altre, l'energia interna del sistema canviarà. Vist d'una altra manera, aquesta llei permet definir la calor com l'energia necessària que ha d'intercanviar el sistema per compensar les diferències entre treball i energia interna. Va ser proposada per Antoine Lavoisier.
L'equació de la conservació de l'energia és la següent:
Que aplicada a la termodinàmica tenint en compte el criteri de signes termodinàmic, queda de la forma:
Que es llegeix: La calor aplicada a un sistema tancat és igual a l'augment de la seva energia interna (U) més els treball mecànic que el sistema fa contra les forces externes.
Segona llei de la termodinàmica[modifica]
Aquesta llei regula la direcció en què s'han de dur a terme els processos termodinàmics i, per tant, la impossibilitat que ocorrin en el sentit contrari, com per exemple, que una taca de tinta dispersada en l'aigua pugui tornar a concentrar-se en un petit volum. També estableix, en alguns casos, la impossibilitat de convertir completament tota l'energia d'un tipus a un altre sense pèrdues. D'aquesta manera, la segona llei imposa restriccions per a les transferències d'energia que hipotèticament poguessin dur a terme tenint en compte només el primer principi.[10]
Aquesta llei permet definir una magnitud física anomenada entropia tal que, per a un sistema aïllat, és a dir, que no intercanvia matèria ni energia amb el seu entorn, la variació de l'entropia sempre ha de ser més gran o igual a zero i només és igual a zero si el procés és reversible.
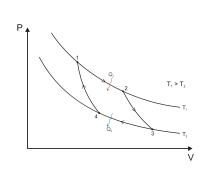
Aquesta llei sorgeix de generalitzar l'observació que en posar dos cossos en contacte la calor sempre es transmet del cos que està a temperatura més alta cap al que està a temperatura més baixa. La llei diu que això que no passa en posar els cossos en contacte, tampoc no pot passar per qualsevol mecanisme, procés, o enginy que al final tingui només aquest resultat: que el cos fred transmeti calor al cos calent i la resta d'elements del sistema tornin al mateix estat en què es trobaven al començament.
Existeixen nombrosos enunciats equivalents per definir aquest principi, destacant el de Clausius i el de Kelvin:
- Enunciat de Clausius. En paraules de Sears és: "No és possible cap procés que té com a únic resultat l'extracció de calor d'un recipient a una certa temperatura i l'absorció d'una quantitat igual de calor per un recipient a temperatura més elevada".
- Enunciat de Kelvin. No hi ha cap dispositiu que, operant per cicles, absorbeixi calor d'una única font i el converteixi íntegrament en treball.
Si existís un dispositiu que partint d'un estat inicial tornés al mateix estat inicial (un cicle) absorbint calor d'un única font i transformant-lo íntegrament en treball, llavors es podria invertir aquest treball en forma de treball dissipatiu (treballant contra les forces de fregament o fent passar corrent per una resistència elèctrica) en lliurar-lo en forma de calor a una font a temperatura superior i el resultat seria un procés que tindria com a únic resultat l'extracció de calor d'un recipient a certa temperatura i l'absorció d'una quantitat igual de calor a una temperatura més elevada.
Kelvin → Classius
Una altra interpretació. És impossible construir una màquina tèrmica cíclica que transformi calor en treball sense augmentar l'energia termodinàmica de l'ambient.
Degut a això es pot concloure que una màquina tèrmica cíclica que converteix calor en treball sempre ha de treballar entre una font calenta i una freda, una part de la calor extreta de la font calenta el pot transformat en treball i una altra part l'ha de cedir a la font freda.
Es defineix el rendiment termodinàmic d'un motor tèrmic com la fracció de calor extret de la font calenta que transforma en treball. Aquest rendiment pot ser zero si tot la calor extreta de la font calenta es lliura a la font freda, per exemple posant-les en contacte. Però no pot ser 1 perquè llavors es tindria una màquina que extreu calor únicament d'un cos i el transforma íntegrament en treball.
Fixeu-vos que si una màquina és reversible (pot treballar al revés, és a dir fer de màquina frigorífica extraient calor de la font freda i lliurant-lo juntament amb el treball que consumeix per operar a la font calenta) llavors el seu rendiment termodinàmic ha de ser el màxim possible: Si n'hi hagués un altre amb un rendiment superior es podria combinar amb la màquina reversible fent de frigorífic i el resultat final seria la producció íntegra de treballa partir de la calor extreta de la font calenta.
Per cada parell de temperatures (T1,T₂) la màquina reversible té un rendiment η que és funció d'aquest parell de temperatures.
A més els rendiments termodinàmics de les màquines reversibles no són completament independents, ja que si es tenen tres fonts de calor a tres temperatures T1, T₂, i T₃ una màquina reversible que operi entre T1 i T₃ ha de tenir el mateix rendiment que dues combinades que operin respectivament entre T1 i T₂ la primera i entre T₂ i T₃ la segona.
Amb aquestes dues observacions més la mesura del rendiment termodinàmic d'una màquina reversible entre dues temperatures que es prenen com a patró més la definició d'un nou concepte de temperatura: la temperatura termodinàmica, permeten definir el concepte d'entropia. L'augment d'entropia d'un sistema (dS) es defineix com el quocient entre la calor que absorbeix i la temperatura a què l'absorbeix mesurant la temperatura a escala termodinàmica:
Això permet expressar la segona llei com: en un procés reversible l'entropia es manté constant i en un d'irreversible l'entropia augmenta.
El rendiment d'una màquina reversible que treballi entre dos fonts de calor que estiguin respectivament a temperatures termodinàmiques T1 i T₂ és:
Tercera llei de la termodinàmica[modifica]
La Tercera de les lleis de la termodinàmica, proposada per Walther Nernst, afirma que és impossible arribar a una temperatura igual al zero absolut mitjançant un nombre finit de processos físics. Pot formular també com que a mesura que un sistema donat s'aproxima al zero absolut, la seva entropia tendeix a un valor constant específic. L'entropia dels sòlids cristal·lins purs es pot considerar amb el valor de zero a temperatures iguals al zero absolut. No és una noció exigida per la termodinàmica clàssica, de manera que és probablement és inadequat parlar de "llei".
Termometria[modifica]
La termometria s'encarrega de la mesura de la temperatura de cossos o sistemes. Per aquest fi, s'utilitza el termòmetre, que és un instrument que es basa en el canvi d'alguna propietat de la matèria a causa de l'efecte de la calor. Així, existeix el termòmetre de mercuri i d'alcohol, que es basen en la dilatació, els termoparells que es basen en el canvi de la conductivitat elèctrica, i els òptics que detecten la variació de la intensitat del raig emès quan es reflecteix en un cos calent. Per poder construir el termòmetre s'utilitza el Principi zero de la termodinàmica.
Temperatura empírica d'un sistema basant-se en la llei zero[modifica]
Existeix la demostració de l'existència de la temperatura empírica d'un sistema basant-se en la llei zero. Per a dos sistemes en equilibri termodinàmic representats per les seves respectives coordenades termodinàmiques (X1, Y1) i (X2, Y2) observem que aquestes coordenades no són funció del temps, per tant és possible trobar una funció que relacionem aquestes coordenades, és a dir:
Siguin tres sistemes hidroestàtic, A, B, C, representats per les seves respectives termodinàmiques: (Pa, Va), (Pb, Vb), (Pc, Vc). Si A i C estan en equilibri ha d'existir una funció tal que:
És a dir:
On les funcions i depenen de la naturalesa dels fluids. Anàlogament, per a l'equilibri dels fluids B i C:
És a dir:
Amb les mateixes consideracions que les funcions, i depenen de la naturalesa dels fluids. La condició donada per la llei zero de la termodinàmica de què l'equilibri tèrmic d'A amb C i B amb C implica així mateix equilibri d'A i B es pot expressar matemàticament com:
Això ens porta a la següent expressió:
Llavors, arribem a la conclusió que les funcions i han de ser de naturalesa tal que es permeti l'eliminació de la variable termodinàmica comú . Una possibilitat, que es pot demostrar com a única, és:
Així mateix:
Un cop cancel·lades totes les parts que contenen a podem representar:
I mitjançant una simple repetició de l'argument, tenim la següent expressió:
I així successivament per a qualsevol nombre de sistemes en equilibri termodinàmic.
Amb aquesta seqüència hem demostrat que per a tots els sistemes que es trobin en equilibri termodinàmic entre si hi ha les respectives funcions en què els valors numèrics són iguals per a cadascun d'aquests sistemes en equilibri. Aquest valor numèric pot ser representat amb la lletra grega θ i serà definit com la temperatura empírica dels sistemes en equilibri termodinàmic.
Així, tenim que tot equilibri termodinàmic entre dos sistemes és equivalent a un equilibri tèrmic d'aquests, és a dir, a una igualtat de les temperatures empíriques d'aquests sistemes.
Escales de temperatura: Celsius, Kelvin i Fahrenheit[modifica]
Una propietat termomètrica d'una substància és aquella que varia en el mateix sentit que la temperatura, és a dir, si la temperatura augmenta el seu valor, la propietat també ho farà, i viceversa. El que es necessita per construir un termòmetre són punts fixos, és a dir, processos en els quals la temperatura roman constant. Exemples de processos d'aquest tipus són el procés d'ebullició i el procés de fusió.
Els punts generalment utilitzats són el procés d'ebullició i de solidificació d'alguna substància, durant els quals la temperatura roman constant.
Hi ha diverses escales per mesurar temperatures, les més importants són:
Escala Celsius[modifica]
Per aquesta escala, es prenen com a punts fixos, els punts d'ebullició i de solidificació de l'aigua, als quals se'ls assignen els valors de 100 i 0 respectivament. En aquesta escala, aquests valors s'escriuen com a 100 ° i 0 °. Aquesta unitat de mesura es llegeix com a grau Celsius i es denota per [°C]. El grau Celsius, representat pel símbol °C, és la unitat creada per Anders Celsius per a la seva escala de temperatura. Es va fer servir com a referència per al kelvin i és la unitat de temperatura més utilitzada internacionalment.
A partir de la seva creació el 1750 va ser anomenada grau centígrad (s'escrivia °c, en minúscula). Però el 1948 es va decidir el canvi en la denominació oficial per evitar confusions amb la unitat d'angle també anomenada grau centígrad (grau geomètric), encara que la denominació prèvia se segueix emprant extensament en l'ús col·loquial.
Fins a 1954 es va definir assignant el valor 0 a la temperatura de congelació de l'aigua, el valor 100 a la de temperatura d'ebullició-ambdues mesures a una atmosfera de pressió-i dividint l'escala resultant en 100 parts iguals, cada una d'elles definida com a 1 grau. Aquests valors de referència són molt aproximats però no correctes per la qual cosa, a partir de 1954, es defineix assignant el valor 0,01 °C a la temperatura del punt triple de l'aigua i definint 1 °C com la fracció 1/273, 16 de la diferència amb el zero absolut.
La magnitud d'un grau Celsius (1 °C) és equivalent a la magnitud d'un kelvin (1 K), ja que aquesta unitat es defineix com igual a la primera. No obstant això, les escales són diferents perquè l'escala Kelvin pren com a valor 0 el zero absolut. Atès que al zero absolut correspon un valor de -273,15 °C, la temperatura expressada en graus Celsius i en kèlvins difereix en 273,15 unitats. La conversió de graus Celsius a graus Fahrenheit s'obté multiplicant la temperatura a Celsius per 1,8 (9/5) i sumant 32.
Escala Kelvin o absoluta[modifica]
En aquest cas, l'escala va ser establerta a partir de l'escala Celsius ; el valor de 0 en l'escala Kelvin correspon al zero absolut, temperatura a la qual les molècules i àtoms d'un sistema tenen la mínima energia tèrmica possible. Cap sistema macroscòpic pot tenir una temperatura inferior. En escala Celsius aquesta temperatura correspon a -273 °C. Aquesta unitat de mesura es llegeix kelvin (en minúscules) i es representa amb el símbol K. Aquesta unitat s'anomena també Escala absoluta i és també la unitat adoptada pel Sistema Internacional d'Unitats.
Atès que 0 K corresponen a -273 °C, es pot trobar una fórmula de conversió, entre l'escala Celsius i l'escala Kelvin, de la manera següent:
- T = tc + 273 °
La lletra T representa la temperatura en kèlvins i la lletra tc representa la temperatura en graus Celsius.
Escala Fahrenheit[modifica]
En aquesta escala també es van utilitzar punts fixos per construir, però en aquest cas van ser els punts de solidificació i d'ebullició del clorur amònic en aigua. Aquests punts es van marcar amb els valors de 0 i 100 respectivament. La unitat d'aquesta escala s'anomena grau Fahrenheit i es representa amb el símbol [°F]. Atès que en escala Celsius, els valors de 0 °C i 100 °C corresponen respectivament a 32 °F i 212 °F respectivament, la fórmula de conversió de graus Celsius a Fahrenheit és:
- tf = tc + 32 °
Aquí el símbol tf representa la temperatura en graus Fahrenheit i el símbol tc representa la temperatura en graus Celsius.
Referències[modifica]
- ↑ 1,0 1,1 El llenguatge de la física Julio Pellicer, M. Jesús Hernández i Vicente M. Aguilella. Revista de Física. 2n semestre de 1998. pàg. 55. Institut d'Estudis Catalans.
- ↑ J. R. Partington. Dover. A Short History of Chemistry, 1989. ISBN 0-486-65977-1. OCLC 19353301.
- ↑ 3,0 3,1 Perrot, Pierre. Oxford University Press. A to Z of Thermodynamics, 1998. ISBN 0-19-856552-6. OCLC 123283342 38073404.
- ↑ Gandia, Vicent. Manual de Termodinàmica. segona. València: Universitat de València, 1998 (Educació. Materials.). ISBN 84-370-2319-X., pàg. 21
- ↑ Kelvin, William T. (1849) "An Account of Carnot's Theory of the Motive Power of Heat - with Numerical Results Deduced from Regnault's Experiments on Steam." Transactions of the Edinburg Royal Society, XVI. January 2. Scanned Copy
- ↑ Cengel, Yunus A.; Boles, Michael A.. McGraw-Hill. Thermodynamics - an Engineering Approach, 2005. ISBN 0-07-310768-9.
- ↑ Gibbs, Josiah Willard. «On the Equilibrium of Heterogeneous Substances» (en anglès). Massachusetts Institute of Technology, 1876. Arxivat de l'original el 2012-10-26. [Consulta: 4 febrer 2012].
- ↑ Gibbs, Willard. The Scientific Papers of J. Willard Gibbs, Volume One: Thermodynamics. Ox Bow Press, 1993. ISBN 0-918024-77-3. OCLC 27974820.
- ↑ F.W. Sears i G.L. Saligner. Thermodynamics, Kinetic theory, and Statistical Thermodynamics. Addison Wesley Capítol 1 apartats 5 i 6
- ↑ Carnot, Sadi; Rudolf Clausius, William T. Kelvin. Escrits fonamentals sobre el segon principi de la termodinàmica. Barcelona: Institut d'Estudis Catalans. Editorial Pòrtic. Eumo editorial., 1999 (Clàssics de la ciència.). ISBN 84-7283-457-3.
Vegeu també[modifica]
- Llista de propietats termodinàmiques
- Cicle termodinàmic
- Principi zero de la termodinàmica
- Primer principi de la termodinàmica
- Segon principi de la termodinàmica
- Tercer principi de la termodinàmica
- Zero absolut
- Temperatura
Enllaços externs[modifica]
- Webs educatives sobre termodinàmica Arxivat 2015-06-14 a Wayback Machine. (en anglès)
- Termodinàmica a ScienceWorld (anglès)
- Història de la termodinàmica (anglès)
- Shakespeare i la termodinàmica (anglès)
- Termodinàmica bioquímica (anglès)
- Termodinàmica i mecànica estadística (anglès)






































