Virus de la immunodeficiència humana
 | |
| Dades | |
|---|---|
| Malaltia | sida i malaltia infecciosa pel virus de la immunodeficiència humana |
El Virus de la immunodeficiència humana, comunament anomenat VIH, és l'agent causal de la malaltia de la sida. Es tracta d'un virus del grup dels retrovirus que fou aïllat per primer cop l'any 1983 per l'equip de Luc Montagnier a França.
El virus és esfèric, dotat d'un embolcall i amb una càpsida proteica. El seu genoma és una cadena d'ARN monocatenari que es copia provisionalment a ADN per poder multiplicar-se i integrar-se en el genoma de la cèl·lula que infecta. Els antígens proteics de l'embolcall exterior s'acoblen de forma específica amb proteïnes de membrana de les cèl·lules susceptibles a ser infectades, especialment els limfòcits T4. El procés de conversió d'ARN a ADN és una característica principal dels retrovirus i es porta a terme mitjançant accions enzimàtiques de transcriptasa inversa. Amb la demostració de l'existència de la transcriptasa inversa, es va iniciar la recerca dels retrovirus humans en la dècada del 1970, que va permetre l'aïllament en 1980 del virus de la leucèmia HTLV-I (R. Gallo y cols). El VIH té un diàmetre d'uns cent nanòmetres. La seva part exterior és la “coberta”, una membrana que originalment pertanyia a la cèl·lula en la que s'ha fagocitat el virus. En la coberta es troba una proteïna del virus, la gp41, o “glicoproteïna transmembrana”. Connectada a la gp41 està la gp 120, la qual pot unir-se al receptor CD4 localitzat a la superfície dels limfòcits T per penetrar dins seu. El nucli té una càpside composta per la proteïna p24. En el seu interior està l'ARN, la forma d'informació genètica del VIH. En 2012 hi havia 35,3 milions de persones amb VIH en el món, de les quals 25 milions vivien en l'Àfrica Subsahariana.[1]
Descobriment
Des de 1981 es van detectar casos sorprenents d'infecció per Pneumocystis jiroveci (aleshores designat Pneumocystis carinii), un fong emparentat amb les formes originals dels Ascomycetes, conegut per infectar pacients severament immunodeprimits. Inicialment es va observar un grup de casos semblants en què estaven implicats homes homosexuals i on apareixien simultàniament amb infeccions per citomegalovirus i candidosi. Inicialment, es va pensar que la causa havia d'estar lligada a pràctiques comunes entre la població homosexual masculina.
Aviat van començar a aparèixer casos que afectaven a homes o dones heterosexuals usuari de drogues intravenoses, així com als seus fills; també entre pacients no homosexuals i amb hàbits saludables que havien rebut transfusions de sang sencera o de productes sanguinis per la seva condició d'hemofílics. Aviat es va pensar, per criteris bàsicament epidemiològics, que la causa havia de ser un agent infecciós que es transmetia de forma semblant a com ho fa el virus de l'hepatitis B.

Diferents equips van començar a buscar un virus associat als casos coneguts d'immunodeficiència adquirida, potser un retrovirus com el que produïa la immunodeficiència del gat o com el HTLV, productor d'un tipus de leucèmia. El 1983, a l'Institut Pasteur de París, un equip dedicat a la investigació de la relació entre retrovirus i càncer dirigit per JC Chermann, F. Barré-Sinoussi i L. Montagnier, va trobar un candidat al que va anomenar lymphadenopathy-associated virus (virus associat a la linfoadenopatía, LAV).
El 1984 l'equip de R. Gallo, descobridor del HTLV, únic retrovirus humà conegut llavors, va confirmar el descobriment, però anomenant al virus Human T lymphotropic Virus Type III (virus limfotròpic T humà tipus III, amb les sigles HTLV-III). Es va produir una subseqüent disputa sobre la prioritat en la qual va quedar clar que Gallo havia descrit el virus només després d'haver rebut mostres dels francesos. Com a part de la resolució del conflicte, el virus va adquirir la seva denominació definitiva, Human Immunodeficiency Virus (HIV) que en català s'expressa com a Virus de la Immunodeficiència Humana (VIH).
En el mateix any, 1983, en què es va identificar el virus, diversos equips van començar a treballar en la seqüència del seu genoma, publicada a principis de 1985, i va començar també la caracterització de les seves proteïnes.
| Risc estimat d'adquisició del VIH segons el tipus d'exposició[2] | ||||
|---|---|---|---|---|
| Tipus d'exposició | Nombre estimat d'infeccions per cada 10.000 exposicions a una font infectada | |||
| Transfusió de sang | 9,000[3] | |||
| Part | 2,500[4] | |||
| Injecció de droga | 67[5] | |||
| Coït anal receptiu * | 50[6][7] | |||
| Agulla de laboratori percutània | 30[8] | |||
| Coït vaginal receptiu * | 10[6][7][9] | |||
| Coït anal insertiu * | 6.5[6][7] | |||
| Coït vaginal insertiu * | 5[6][7] | |||
| Felació receptiva* | 1[7] | |||
| Felació insertiva* | 0.5[7] | |||
| * sense ús de preservatiu | ||||
Transmissió
El VIH ha estat trobat a la sang, el semen, la saliva, les llàgrimes, l'orina, el líquid cefaloraquidi, el líquid amniòtic, la llet materna.[10] La pell (especialment quan hi ha rascades, talls, abrasions, dermatitis, o altres lesions), les membranes mucoses de l'ull, el nas, la boca i possiblement el tracte respiratori (tràquea, bronquis i pulmons) haurien de ser considerats com una via potencial per a l'entrada del virus. També es troba present, i en quantitat suficient, en el líquid cefaloraquidi, líquid amniòtic, líquid pleural, sinovial, peritoneu i pericàrdic.
Les tres principals formes de transmissió són:
- Sexual (acte sexual sense protecció). Vés a malaltia de transmissió sexual. El contagi es produeix pel contacte de secrecions infectades amb la mucosa genital, rectal o oral de l'altra persona.
- Parenteral (per sang). És una forma de contagi a través de xeringues contaminades que es dóna per la utilització de drogues intravenoses i/o a través dels serveis sanitaris, com ha passat de vegades en països pobres, els quals no fan servir les millors mesures d'higiene. Aquesta forma de transmissió també es fa en persones, com hemofílics, que han rebut una transfusió de sang contaminada o productes contaminats derivats de la sang; en treballadors de la salut (en menor grau) que estiguin exposats a la infecció en un accident de treball
- Vertical (de mare a fill). El contagi pot ocórrer durant les últimes setmanes de l'embaràs, durant el part, o alletar el nadó. D'aquestes situacions, el part és la més problemàtica. Actualment en països desenvolupats la transmissió vertical del VIH està totalment controlada (sempre que la mare sàpiga que és portadora del virus), ja que des de l'inici de l'embaràs (i en certs casos amb anterioritat fins i tot) se li dóna un Tractament anti-retroviral de gran activitat (TARGA) especialment indicat per a aquestes situacions. El part es realitza per cesària (generalment), se suprimeix la producció de llet ( i amb això la lactància), i fins i tot es dóna tractament antiviral el nadó.
Estructura del virió
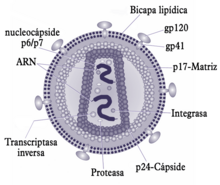
El virió (partícula infectant) del VIH es diferencia en l'estructura dels prèviament coneguts retrovirus. Fa uns 120 nm de diàmetre i és aproximadament esfèric.
El seu genoma es basa físicament en dues còpies d'ARN monocatenari positiu (la seva seqüència és com la de l'ARN missatger corresponent) protegides per proteïnes, que formen la nucleocàpside, i tancades dins d'una càpside troncocònica, al seu torn envoltada per un embolcall de bicapa lipídica, robada primer a la membrana plasmàtica de la cèl·lula hoste, però dotada de proteïnes pròpies. Dins de l'embolcall hi ha també enzims propis del virus, incloses una transcriptasa inversa, una integrasa - dins de la càpside - i una proteasa. La primera és necessària per a la retrotranscripción (la síntesi d'ADN prenent el RNA víric com a motlle), i la segona ho és per facilitar la integració de l'ADN viral en el genoma humà.
Genoma i composició
El genoma del VIH-1, quan està integrat en l'ADN de l'hoste, és a dir, com a provirus, mesura 9,8 kpb (9.800 parells de nucleòtids). Tots dos extrems apareixen flanquejats per seqüències repetides (LTR, per Long Terminal Repeats). El provirus conté 9 gens. Tres d'ells codifiquen per proteïnes estructurals comunes a tots els retrovirus (els gens gag, pol i env), sent els sis restants gens no estructurals, que codifiquen per dues proteïnes reguladores (gens tat i rev) i quatre per a proteïnes accessòries (gens vpu, VPR, vif i nef).
El genoma del VIH-2 és una mica més llarg (10,3 kpb) i li falta el gen vpu, presentant en el seu lloc un altre anomenat vpx.
Proteïnes estructurals
Les proteïnes estructurals són codificades pels gens gag, pol i env, i la seva seqüència cobreix la major part del genoma viral, quedant només una part menor per a la resta dels gens.
Productes dels gens gag i pol
El gen gag codifica una proteïna precursora, la p55, que després s'associa, durant la gemmació per la qual s'alliberen noves partícules víriques des de la cèl·lula infectada, a dues còpies de l'ARN viral (pel qual presenta una regió afí) i a altres proteïnes virals i cel·lulars. Una proteasa, producte del gen pol, talla durant la maduració del virió la proteïna p55 en quatre proteïnes que s'incorporen als seus llocs respectius:
- La proteïna p24 forma la càpside
- La proteïna p17 constitueix la matriu, situada sota l'embolcall, a la que estabilitza. Una part de les proteïnes s'uneixen al complex molecular que acompanya a l'ADN viral a l'interior del nucli. A la superfície de la proteïna hi ha una regió cariofílica (literalment afí al nucli) que és reconeguda per la maquinària molecular d'importació nuclear. Aquest és el mecanisme que permet al VIH infectar les cèl·lules diferenciades, no destinades a dividir-se (cosa que no passa amb cap altre retrovirus)
- Les proteïnes p6 i p7 (o p9) formen la nucleocàpside. La regió de la p55 corresponent al polipèptid p6 és responsable de la incorporació de la proteïna accessòria VPR (producte de la traducció del gen VPR) al virió en formació i de la interacció amb la membrana de la cèl·lula que fa possible la gemmació. La p7 (P9) és responsable del reconeixement i la incorporació de l'ARN al virió i a més intervé en la transcripció inversa facilitant-la.
Dins de la càpside, a més de les dues còpies idèntiques de l'ARN viral hi ha exemplars de tres enzims necessaris per a la multiplicació del virus: una transcriptasa inversa, una integrasa i una proteasa. Aquests enzims, així com la ARNasa, es produeixen a partir de la proteïna Pol, després del tall d'una proteïna precursora mixta derivada de la cotraducció, una de cada 20 vegades, dels gens gag i pol. La mateixa proteasa vírica trenca la proteïna anterior, amb una eficiència limitada, per obtenir les proteïnes Gag (p55) i Pol Després la proteïna precursora Pol és tallada al seu torn per formar les quatre proteïnes funcionals esmentades:
- Proteasa VIH-1 (p10). Es tracta d'una aspartil-proteasa la forma funcional de la qual és un dímer del que es coneix l'estructura tridimensional. Actua tallant les peces de les proteïnes Gag, Pol i de la Gag-Pol. Una part dels fàrmacs utilitzats contra el VIH són inhibidors de la seva funció.
- Transcriptasa inversa (p50). La seva funció és la síntesi de l'ADN de doble cadena del provirus utilitzant com a patró la cadena monocatenària de l'ARN viral. És una ADN-polimerasa que pot actuar com a dependent de l'ADN tant com de l'ARN. Un cop formada la primera cadena d'ADN, complementària a l'ARN viral, la ARNasa el separa d'ell, el que permet a la transcriptasa inversa executar la síntesi de la segona cadena d'ADN prenent com a motlle la primera que es va formar. Així doncs, per a la síntesi de la primera cadena, l'activitat de la transcriptasa inversa és ARN-dependent, però per a la de la segona és ADN-dependent. Existeixen múltiples fàrmacs contra l'activitat de la transcriptasa inversa.
- ARNasa (p15). Com s'ha dit, separa les cadenes d'ARN de les de l'ADN durant la transcripció inversa.
- Integrasa (p31). Realitza la inserció de l'ADN proviral en el genoma de la cèl·lula hoste. No es requereix ATP per a la seva activitat i ha de complir successivament tres funcions:
- Amb una activitat exonucleasa talla dos nucleòtids de l'extrem 3 'de cada una de les dues cadenes de l'ADN proviral.
- Amb una activitat endonucleasa (de doble cadena) talla l'ADN de l'hoste en el punt d'integració. No hi ha un lloc fix en el genoma perquè això es faci, sinó que passa a qualsevol regió accessible de la cromatina, el que se suposa que afavoreix l'expressió del provirus, en coincidir aquestes regions del genoma amb les més transcrites.
- Finalment, amb una activitat ligasa, l'ADN proviral és soldat, mitjançant només un enllaç covalent a cada extrem, en l'ADN cel·lular.
En l'actualitat existeix un fàrmac comercialitzat contra l'activitat de la integrasa, el raltegravir.
Productes del gen env
L'embolcall es basa en una bicapa lipídica, el mateix que qualsevol membrana biològica, i els seus components estructurals bàsics procedeixen de la membrana plasmàtica de la cèl·lula parasitada. A més a més, però, l'embolcall porta regularment espaiades 72 espícules, que són complexos proteics integrats a la membrana formats per proteïnes virals codificades pel gen env. Cada espícula està formada per una peça de la proteïna gp41, integrada a la membrana, i un cap extern format per la proteïna gp120, essencial per a l'acoblament amb l'exterior de certes cèl·lules prèviament a la seva invasió. Entre els dos components de les espícules hi ha una unió no covalent. Les proteïnes gp41 i gp120 se sintetitzen com una sola poliproteïna, gp160, amb la informació del gen env abans que sigui tallada per una proteasa de la cèl·lula. La proteïna Env existeix com a trímer en la superfície dels virions i les cèl·lules infectades.
Els fàrmacs inhibidors de la fusió funcionen contra la proteïna gp41, per evitar la seva unió als limfòcits.
Proteïnes reguladores
Tat
La proteïna Tat existeix en dues formes: una llarga, de 101 restes aminoàcids de longitud, i una altra més curta, de només 72. La segona es produeix quan en una fase inicial es produeix una edició completa de l'ARNm viral; la primera forma es produeix quan en una fase més tardana només es realitza una edició parcial. La proteïna Tat (per transactivator) és imprescindible per a la producció de nous virions que promou activament. La proteïna s'uneix a una regió de 59 nucleòtids situada a l'extrem 5 'de l'ARN viral anomenada TAR (Transactivator Active Region) i actua com un transactivador, una cosa excepcional, ja que aquests se solen unir a l'ADN, no a l'ARN. Quan l'extrem inicial del genoma viral ha estat transcrit des de l'ADN proviral, la proteïna Tat s'uneix a ell i promou la seva elongació afavorint la transcripció de la resta de la cadena.
Rev
Regula l'expressió de l'ARN viral controlant el ritme d'exportació de l'ARNm.[11]
Tat i Rev: acció conjunta
L'acció sinergística del Tat i el Rev incrementa fortament l'expressió de proteïnes virals. Els papers que Tat i Rev exerceixen en la regulació transcripcional de l'HIV-1 i en l'expressió de proteïnes estructurals, respectivament, fan del Tat i el Rev unes proteïnes reguladores essencials per al cicle de vida del VIH. Les seves funcions faciliten l'expressió de proteïnes virals en dues etapes. Després de la integració de l'ADN proviral i de la seva transcripció en un nivell basal, només els RNAms de 2 KB es transporten al citoplasma. Això permet la síntesi de Tat, Rev i Nef. La Tat i la Rev llavors són transportades al nucli, on actuen per tal d'augmentar la transcripció de l'ADN del provirus (Tat) i del transport de tots els RNAms virals al citoplasma (Rev). L'expressió de proteïnes codificada per les classes de RNAm de 9 KB i 4 KB (Gag, Gag-Pol, Env, VPR, Vif, i de Vpu) aleshores pot passar. Estudis on 'han canviat gens virals han determinat que Vif, VPR, Vpu i Nef no són essencials per a la producció de partícules infeccioses en cultius cel·lulars in-vitro. No obstant això, la conservació d'aquestes proteïnes accessòries en el genoma del VIH suggereix que totes tenen papers importants durant el cicle infecciós a l'hoste. Els rols d'aquestes proteïnes seran descrits a continuació.
Proteïnes accessòries
Vif: increment en l'activitat i la protecció del genoma viral
Vif és una proteïna de 193 aminoàcids que està present dins dels virions en nivells baixos, i interacciona amb en ARN genòmic viral. La divisió d'aquesta proteïna redueix la inefectivitat del VIH-1 en cultius cel·lulars i en models animals de patogènesi. No obstant això, el mecanisme d'acció de Vif s'ha començat a entendre recentment. L'absència de Vif en partícules infeccioses no pot ser compensada amb l'expressió de la Vif en les cèl·lules infectades. Estudis recents han demostrat que la Vif es requereix per eliminar l'acció del factor ApoBEC3G, la qual és una desaminasa de citidinas que converteix la citosina en uracil, i fa servir com a substrat l'ADN de cadena senzilla. A més, aquest enzim possiblement actua durant el cicle de la transcriptasa inversa, modificant així la cadena negativa del DNA. L'ApoBEC3G és selectivament incorporada dins de les partícules de VIH, resultant en un alt nivell de mutacions en el genoma viral. Atès que aquests alts nivells de mutació són perjudicials per a la viabilitat del virus, VIH ha evolucionat una estratègia per abolir aquesta poderosa barrera. No obstant això, estudis recents suggereixen que l'ApoBEC3G no requereix la seva acció enzimàtica per tenir efecte. Estudis més recents han afirmat que l'ApoBEC3G té un rol en la inhibició de certes fases en el cicle de la transcriptasa inversa.
Vpu: facilita el despreniment de virions en les cèl·lules infectades
La Vpu és una proteïna de 81 aminoàcids que és inserida en membranes per mitjà del seu extrem N-terminal. La Vpu s'acumula en l'aparell de Golgi i en endosomes cel·lulars, és única en el VIH-1 i no hi ha homòlegs en lentivirus relacionats com el VIH-2 i el VIS. A la Vpu se li han atribuït dues activitats:
Degradació de la proteïna CD4
En l'absència de Vpu, la proteïna CD4 interacciona amb la proteïna viral gp160 (acabada de sintetitzar) per formar un complex insoluble, el qual reté gp120 dins de la cèl·lula. La regió citoplasmàtica de Vpu es pot unir amb CD4 i amb la proteïna ß-TrCP. Això indueix la ubiquitinizació de CD4 i la seva subseqüent degradació pel proteasoma, incrementant així l'expressió de gp120 en la superfície cel·lular.
Realça el despreniment de virions de la membrana cel·lular
Aquesta activitat depèn de la regió transmembrana de Vpu. En absència de Vpu, els virions s'acumulen en la superfície cel·lular en un estat parcialment després. L'expressió de Vpu resulta de l'alliberament facilitat de virions de la membrana cel·lular. Remarcablement, aquest efecte no està restringit només al VIH-1, Vpu també facilita el despreniment d'altres virus no relacionats. El mecanisme pel qual això passa és desconegut. S'ha suggerit que Vpu facilita la fluïdesa de la membrana cel·lular per mitjà d'un canal de cations. També s'ha suggerit que Vpu causa disrupció d'interaccions entre proteïnes del VIH i de la superfície cel·lular, cosa que prevé l'endocitosi de virions recentment despresos de la cèl·lula.
Cicle de replicació

Les cèl·lules que el VIH envaeix són essencialment els limfòcits T CD4 +, però també en menor mesura els monòcits / macròfags, les cèl·lules dendrítiques, les cèl·lules de Langerhans i les cèl·lules de microglia del cervell. La replicació viral té ja lloc en teixits diversos (de ganglis limfàtics, intestí, cervell, tim, ...). Els òrgans limfoides, sobretot els ganglis limfàtics, constitueixen la principal seu de la seva replicació. El virus està present en nombrosos líquids de l'organisme, en particular la sang i les secrecions genitals.
La replicació del virus es desenvolupa en les següents etapes:
- La fixació representa la primera etapa en la invasió d'una cèl·lula. Es basa en el reconeixement i l'acoblament mutu de proteïnes de l'embolcall del virió, les gp120 i gp41, i els receptors de la cèl·lula blanca, els CD4. Aquest reconeixement no és possible sense ajuda de coreceptors propis de les cèl·lules susceptibles de ser envaïdes. En el cas dels macròfags, aquests són els CCR5 i en el cas dels LT4, són els CXCR4, que interaccionen amb la proteïna superficial. Macròfags i LT4 tenen en comú el seu principal receptor: el receptor CD4. Aquest reconeixement és una condició obligada perquè el virus arribi a penetrar dins la cèl·lula i pugui continuar amb el procés d'infecció.
- La penetració és el segon pas: un cop reconegut el virió pels receptors de superfície, es buida el material genètic dins de la cèl·lula fusionant l'embolcall lipídica del virió amb la membrana plasmàtica de la cèl·lula. Protegits per la càpside i les nucleocàpside, els dos ARN missatgers que formen el genoma viral i les seves proteïnes associades es troben ara en el citoplasma.
- Eliminació de les cobertes proteiques, càpside i nucleocàpside, quedant l'ARN víric lliure en el citoplasma i llest per ser processat.
- La transcripció inversa de l'ARN víric per formar ADNc (ADN complementari, monocatenari) amb la mateixa informació. Cadascuna de les dues molècules d'ARN arriba des del virió associada a una molècula de transcriptasa inversa, que s'ocupa del procés. Les dues molècules d'ADNc s'associen per formar una molècula d'ADN, que és la forma química de guardar la informació.
- El pas següent és la integració del genoma víric en el genoma de la cèl·lula hoste. Per a això aquest penetra en el nucli i s'insereix en l'ADN cel·lular amb ajuda d'una integrasa, que procedeix del virió infectant.
- Es realitza la 'transcripció de l'ADN víric pels mecanismes normals de la cèl·lula. El resultat de la transcripció és un ARNm (ARN missatger).
- L'ARNm obtingut és complex, constituït per una successió d'introns (parts no informatives) i exons (parts informatives). Ha de ser processat per proteases i ligases abans que la informació que conté pugui servir per fabricar les proteïnes corresponents. Un cop processat, l'ARNm pot sortir del nucli a través dels porus nuclears.
- Un cop al citoplasma l'ARNm proporciona la informació per a la traducció, és a dir, la síntesi de proteïnes, que és realitzada a través de l'aparell molecular corresponent, del qual formen part fonamentalment els ribosomes. El resultat de la traducció no és immediatament les proteïnes funcionals, sinó que primer se sintetitzen poliproteïnes que encara han de ser tallades en fragments.
- Per l'acció de proteases específiques del VIH, les poliproteïnes són processades (es tallen) per formar les proteïnes constitutives del virus.
- Les proteïnes víriques fabricades s'ensamblen, juntament amb ARN proviral, per formar els components interns de l'estructura del virió, els que constitueixen la càpside i el seu contingut.
- L'últim pas és la gemmació, quan el nucleoide víric s'aproxime a la membrana plasmàtica i es fa embolicar en una vesícula que acaba per desprendre's, formant un nou virió o partícula infectant. A cada cèl·lula infectada s'acoblen diversos milers de nous virions, encara que molts són incomplets i no poden infectar.
Origen i evolució
Com en moltes altres malalties infeccioses emergents, la infecció per VIH va iniciar la seva existència per zoonosi, és a dir per contagi des d'altres espècies. L'emergència de la SIDA i la identificació del VIH van estimular investigacions que han permès determinar que les variants del VIH formen part d'un ampli grup de lentivirus relacionats que s'observen en una gran varietat de primats. Se'ls ha anomenat SIV, sigles en anglès de Simian Immunodeficiency Virus, per analogia amb el VIH, no perquè produeixin primàriament la síndrome que anomenem SIDA en els seus hostes naturals.[12]
Els SIV demostren un gran parentiu amb les dues espècies del VIH quan s'apliquen les tècniques moleculars d'anàlisi filogenètica. Mitjançant aquestes s'interpreta la història del canvi i diversificació evolutius dels gens per, entre altres resultats útils, reconstruir el parentiu de les espècies.

El VIH-1, responsable de l'actual pandèmia, ha resultat estar estretament relacionat amb el SIVcpz, que infecta a poblacions de la subespècie Centreafricana del ximpanzé comú (Pan Troglodytes Troglodytes). El SIVcpz, al seu torn, sembla derivar per recombinació, (un fenomen que es produeix fàcilment quan infecten al mateix individu dues soques víriques diferents) de l'SIVrcm, propi del mangabey de collar (Cercocebus Torquatus), i del SIVgsn, propi del cercopitec del nas blanc ( Cercopithecus nictitans).[13] Les distribucions actuals de les espècies implicades se solapen, i dels ximpanzés se sap que cacen micos petits per menjar-los, el que hauria facilitat la coinfecció per soques diverses de SIV. La subespècie oriental del ximpanzé, Pan Troglodytes Schweinfurthi, presenta també infecció amb una soca pròpia del SIVcpz, però genèticament allunyada del clade format pel VIH-1 i les soques de P.t.troglodytes. No s'ha trobat presència del SIVcpz a la subespècie occidental, P. T. Verus, encara que es va observar el contagi en captivitat d'un individu d'aquesta subespècie.
El salt de la barrera d'espècie des de P. t. troglodytes a Homo sapiens sapiens s'ha produït almenys tres vegades, amb variants del VIH-1 que demostren parentiu amb diferents soques, geogràficament més o menys localitzades, de l'SIVcpz. Així doncs, el VIH-1 és un virus polifilètic. El grup M del VIH-1, responsable de la pandèmia actual, va haver de passar als éssers humans a la primera meitat del segle XX. Els grups O i N del VIH-1 estan restringits a l'Àfrica Occidental equatorial, amb el grup N present només al Camerun. Amb les dades actuals, sembla clar que Pan troglodytes roglodytes és el reservori des del qual s'han produït repetidament les infeccions humanes pels virus de l'evolució del qual procedeix el VIH-1.[12]
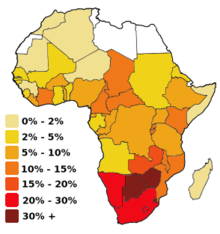
Al seu torn, el VIH-2, estès a l'Àfrica Occidental, procedeix del SIVsm, propi del mangabey fuliginosa (Cercocebus Atys Lunulatus Atys), que habita les selves costaneres del Senegal a Costa d'Ivori. L'anàlisi filogenètic mostra que el pas als éssers humans ha passat també diverses vegades.[14]
Els SIV identificats fins ara es troben de manera específica en unes 35 espècies de primats africans, aproximadament la meitat de les 70 que hi ha al sud del Sàhara, i és a l'Àfrica on sembla que aquest grup monofilètic de virus tenen el seu origen evolutiu, genèticament ben delimitat de la resta dels lentivirus. La prevalença (freqüència de la infecció) és variable entre espècies i poblacions, encara que no superior al 30%, a les poblacions afectades de ximpanzés, però pot passar del 50% en poblacions d'altres primats, com Cercocebus Atys Lunulatus.
En tots els casos coneguts el virus sembla trobar-se prop de l'equilibri amb el seu hoste natural, com a resultat probable d'una més o menys llarga coevolució, observant-se generalment només versions molt atenuades de la síndrome d'immunodeficiència, com una reducció limitada de limfòcits T CD4 +, reducció que no compromet en general la vida de l'individu, encara que en un exemplar de Cercocebus Atys Lunulatus va produir una sida típica després de 18 anys d'incubació. Aquesta dada fa pensar que, almenys en part, és la baixa longevitat, unida a una llarga incubació, el que fa que la immunodeficiència sobrevinguda sigui un resultat excepcional de la infecció en micos.[15] Manipulacions experimentals, amb infeccions repetides, i la transmissió experimental en altres espècies poden donar origen a la patologia característica de la SIDA, com passa quan es inoculen macacos amb SIVsm.[16]
Punts de vista alternatius
Pel que fa a l'existència del VIH i respecte al seu origen, hi ha punts de vista alternatius al consens científic. Inclouen la teoria d'E. Hooper, que diu que la barrera d'espècies va ser travessada com a conseqüència de la utilització de ronyons infectats de ximpanzé per produir vacunes contra la poliomielitis; o l'opinió entre joves africans (considerada insensata), que afirma que el VIH és una arma biològica desenvolupada per Estats Units contra els africans.
Existeixen nombrosos activistes i alguns científics que neguen que la SIDA sigui causat pel VIH, alguns dels quals fins i tot dubten de la mateixa existència del virus aquí descrit. Molts neguen també que existeixi la SIDA com a entitat nosològica (una malaltia singular ben definida) interpretant que la diversitat de formes epidemiològiques i clíniques és pròpia d'una pluralitat de malalties que erròniament o interessada són interpretades com una sola.
Fàrmacs contra el VIH
Existeixen nombrosos fàrmacs dirigits a evitar tant la infecció com la progressió del cicle vital del virus. Aquests fàrmacs es classifiquen clàssicament segons la proteïna a la qual van dirigits (és a dir, al pas replicatiu que inhibeixen en el seu ús). En general, i donades les altes taxes de resistències, està indicat l'ús combinat de fàrmacs en diferents grups (politeràpia), en el que s'anomena TARGA: Teràpia Antiretroviral de Gran Activitat (HAART en anglès). Cap d'aquests fàrmacs s'ha mostrat efectiu, i de fet,un dels més comuns, l'anomenat AZT, és altament tòxic i pot per si mateix causar la malaltia. També existeix el raltegravir, que inhibeix l'enzim de la integrasa i encara no se'n coneixen els resultats finals.
Investigació
A l'Hospital Clínic de Barcelona han observat que un de cada vint pacients, que ells anomenen controladors d'elit, en contacte amb el virus de la sida, multipliquen la reproducció de cèl·lules dentrítiques, que assoleixen una quantitat prou gran com per a evitar la reproducció del virus VIH. Això provoca que aquesta mena de malalts, tot i tenir el virus a la sang i poder-lo contagiar, no desenvolupen mai la malaltia, sense necessitat de cap mena de fàrmac i explica perquè alguns seropositius han passat més de vint anys sense desenvolupar-ne cap símptoma.[17] Paral·lelament, altres investigadors investiguen amb les dosis de medicaments, com per exemple a l'Hospital de Vall d'Hebron, que de moment té una aplicació més immediata, però estan d'adord amb les teories del Clínic.[18]
Els metges i investigadors de l'Hospital Clínic pensen que si troben la manera d'encoratjar la reproducció d'aquestes cèl·lules a la resta de pacients, aquests podrien controlar la malaltia sense necessitat de fàrmacs.[17]
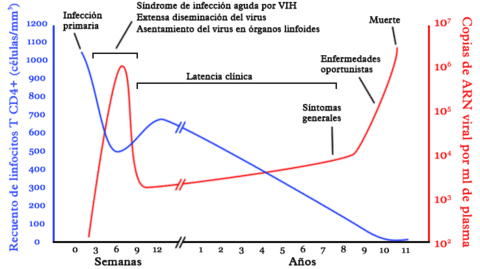
Descriuen que el procés de desenvolupament de la malaltia és el següent: el VIH pren contacte amb el cos humà, entra a la sang i ataca les cèl·lules del sistema immunològic que són les que tenien la funció d'eliminar els virus. Les dendrítiques són la primera baula defensiva que és destruïda pel virus, que a sobre les utilitza per a arribar a través de la sang i entrar als ganglis limfàtics, punt de màxima producció de leucòcits immunològics. El virus destrueix les cèl·lules que utilitza per a reproduir-se, més ràpid en persones amb metabolisme més ràpid (per exemple, els joves). El virus es multiplica 500.000 vegades en només unes hores, destruint cèl·lules del sistema immonològic en fer-ho, després d'haver tingut contacte amb la primera cèl·lula, i creix exponencialment durant alguns mesos, fins a estabilitzar-se amb una presència constant d'unes 50.000 còpies per mil·lilitre de sang. El sistema immunològic queda completament destruït dos o tres anys després que s'hagi iniciat la infecció, i llavors l'afectat comença a patir múltiples infeccions i tumors enfront dels quals no disposa de capacitat defensiva. [17][19]
En canvi, un 5% dels seropositius (els controladors d'elit) reacciona devant la presència del VIH reproduint molt ràpidament les seves cèl·lules dentrítiques, un tipus de les seves cèl·lules del sistema immunològic, precursores de les alfa defensines, que és present en concentracions deu vegades majors a la de la resta de pacients. La presència al cos d'aquesta concentració superior d'alfa defensines fa que el virus no hi pugui entrar per a reproduir-se, de manera que el nombre de còpies de VIH a la sang es manté sempre a nivells de 50 còpies per mil·límetre de sang i a més no aconsegueixi entrar a la resta del sistema immunològic. El pacient no desenvolupa mai la malaltia.[17][19]
Tant les cèl·lules dentrítiques com les alfa defensines s'usen a la investigació de vacunes contra la sida. Les alfa defensines d'una persona es poden modificar. A l'Hospital Clínic investiguen una manera de poder incrementar la seva concentració a la sang en pacients "normals" per tal que actuin com ho fan naturalment als controladors d'elit.[17]
A més del Clínic, hi ha 25 centres més al món que investiguen els controladors d'elit per tal de trobar una vacuna que almenys protegeixi el 80% de persones que la rep, és a dir, la mateixa proporció que les vacunes de la pòlio, la grip, la verola o el xarampió. En agost de 2009 ja va aparèixer l'estudi d'una vacuna basada en una proteïna (però encara no en dendrites i alfa defensines) que es va provar amb 16.000 voluntaris sans i que ja va protegir el 30% d'ells front el virus.[20]
Referències
- ↑ «Factsheet» (en anglès). UNAIDS. Nacions Unides. [Consulta: 2 maig 2015].
- ↑ Smith, D. K., Grohskopf, L. A., Black, R. J., Auerbach, J. D., Veronese, F., Struble, K. A., Cheever, L., Johnson, M., Paxton, L. A., Onorato, I. A. and Greenberg, A. E. Antiretroviral Postexposure Prophylaxis After Sexual, Injection-Drug Use, or Other Nonoccupational Exposure to HIV in the United States, 54, RR02, 2005, pàg. 1-20.
- ↑ Donegan, E., Stuart, M., Niland, J. C., Sacks, H. S., Azen, S. P., Dietrich, S. L., Faucett, C., Fletcher, M. A., Kleinman, S. H., Operskalski, E. A., et al. Infection with human immunodeficiency virus type 1 (HIV-1) among recipients of antibody-positive blood donations, 113, 10, 1990, pàg. 733-739. PMID: 2240875.
- ↑ Coovadia, H. Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS, 351, 3, 2004, pàg. 289-292. PMID: 15247337.
- ↑ Kaplan, E. H. and Heimer, R. HIV incidence among New Haven needle exchange participants: updated estimates from syringe tracking and testing data, 10, 2, 1995, pàg. 175-176. PMID: 7552482.
- ↑ 6,0 6,1 6,2 6,3 European Study Group on Heterosexual Transmission of HIV Comparison of female to male and male to female transmission of HIV in 563 stable couples, 304, 6830, 1992, pàg. 809-813. PMID: 1392708.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Varghese, B., Maher, J. E., Peterman, T. A., Branson, B. M. and Steketee, R. W. Reducing the risk of sexual HIV transmission: quantifying the per-act risk for HIV on the basis of choice of partner, sex act, and condom use, 29, 1, 2002, pàg. 38-43. PMID: 11773877.
- ↑ Bell, D. M. Occupational risk of human immunodeficiency virus infection in healthcare workers: an overview., 102, 5B, 1997, pàg. 9-15. PMID: 9845490.
- ↑ Leynaert, B., Downs, A. M. and de Vincenzi, I. Heterosexual transmission of human immunodeficiency virus: variability of infectivity throughout the course of infection. European Study Group on Heterosexual Transmission of HIV, 148, 1, 1998, pàg. 88-96. PMID: 9663408.
- ↑ Vanrell, J.A.. Manual d'obstetrícia i ginecologia per a pregraduats. Edicions Universitat Barcelona, 1996, p. 265. ISBN 8447515575.
- ↑ Importancia de la proteína Rev
- ↑ 12,0 12,1 Sharp, P. M., Shaw, G. M. & Hahn, B. H. Simian immunodeficiency virus infection of chimpanzees, 79, 2005, pàg. 3891-902.
- ↑ Bailes, E., Gao, F., Bibollet-Ruche, F., Courgnaud, V., Peeters, M., Marx, P. A., Hahn, B. H. & Sharp, P. M. Hybrid origin of SIV in chimpanzees, 300, 2003, pàg. 1713.
- ↑ Santiago, M. L., Range, F., Keele, B. F., Li, Y., Bailes, E., Bibollet-Ruche, F., Fruteau, C., Noe, R., Peeters, M., Brookfield, J. F., Shaw, G. M., Sharp, P. M. & Hahn, B. H. Simian immunodeficiency virus infection in free-ranging sooty mangabeys (Cercocebus atys atys) from the Tai Forest, Cote d'Ivoire: implications for the origin of epidemic human immunodeficiency virus type 2, 79, 2005, pàg. 12515-27.
- ↑ Ling, B., Apetrei, C., Pandrea, I., Veazey, R. S., Lackner, A. A., Gormus, B. & Marx, P. A. Classic AIDS in a sooty mangabey after an 18-year natural infection, 78, 2004, pàg. 8902-8.
- ↑ Heeney, J. L., Dalgleish, A. G. & Weiss, R. A. Origins of HIV and the evolution of resistance to AIDS, 313, 2006, pàg. 462-6.
- ↑ 17,0 17,1 17,2 17,3 17,4 El Clínic descobreix per què alguns infectats de VIH són immunes a la sida. Àngels Gallardo, publicat a El Periódico, 25 de febrer de 2010.
- ↑ Metges i científics celebren la troballa antisida del Clínic. El descobriment de la causa que alguns seropositius no emmalalteixin convenç. Antonio María Yagüe i María Jesús Ibáñez, publicat a El Periódico el 25 de febrer de 2010.
- ↑ 19,0 19,1 Esquema de procés viral en pacients "normals" i en "controladors d'elit" El Periódico, 25 de febrer de 2010
- ↑ Josep Maria Gatell: «Aconseguir una vacuna antisida ja no és utòpic»Entrevista a Josep Maria Gatell, codirector de l'Hivacat, publicada a El Periódico el 26 de febrer de 2010
Vegeu també
Enllaços externs
- [www.plwha.org HIV international travel restrictions and retreats]
- Lloc web d'Acció Solidària, molta informació i vídeos educatius
- 2006 Informe sobre l'epidèmia mundial de la SIDA, elaborat per ONUSIDA
- Informació sobre la prova de VIH a l'Amèrica Llatina
- VIH/SIDA – Situació i reptes de l'epidèmia, resum de l'informe d'ONUSIDA, elaborat per GreenFacts
- Descobreixen dos anticossos que neutralitzen el virus de la SIDA (castellà)
- The Big Picture Book of Viruses: Retriviridae. Fotomicrografies i dibuixos de retrovirus, sobretot del VIH.
- La infecció pel VIH: Guia pràctica Llibre sencer publicat per la Sociedad Andaluza de Enfermedades Infecciosas (614 pàgines).(castellà)
- HIV InSite (anglès)
- YouTube - HIV Replication. Animació en 3D que explica el procés de reproducció del virus. (anglès)
- Mi fallo positivo - El VIH en primera persona (castellà)
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Virus de la immunodeficiència humana |
