Aminoàcid
 | |
| Substància química | classe estructural d'entitats químiques |
|---|---|
| Altres | |
| amfòter | |
Els aminoàcids són compostos orgànics que contenen els grups funcionals amino (-NH₂) i carboxil (-COOH), així com una cadena lateral diferent en cada aminoàcid. Els elements presents en tots els aminoàcids són el carboni (C), l'hidrogen (H), l'oxigen (O) i el nitrogen (N), mentre que el sofre (S) forma part de les cadenes laterals de la cisteïna i la metionina i el seleni (Se) es troba en la selenocisteïna, un aminoàcid més rar. Es coneixen uns 500 aminoàcids,[1] els quals podem classificar per la situació del grup amino com a alpha- (α-), beta- (β-), gamma- (γ-) o delta- (δ-) aminoàcids; també es poden classificar per polaritat, pH, i tipus de cadena lateral (alifàtica, acíclica, aromàtica, amb hidroxils o sofres, etc.). Formant proteïnes, els aminoàcids són el segon component més abundant (l'aigua n'és el primer) en els músculs i altres teixits.[2]
Un alfa aminoàcid té la fórmula química genèrica: H₂NCHRCOOH, on R és un substituent orgànic.[3] El grup amino està enllaçat a l'àtom de carboni immediatament adjacent al grup carboxil (α-carboni). Existeixen altres tipus d'aminoàcids on el grup amino està enllaçat a un àtom de carboni diferent; per exemple, en els gamma- aminoàcids (com l'àcid gamma-aminobutíric) el carboni a què està enllaçat el grup amino està separat del grup carboxil per dos àtoms de carboni. Els alfa-aminoàcids es diferencien per la cadena lateral (grup R) enllaçada al α-carboni, que pot variar de pes des d'un sol àtom d'hidrogen en la glicina fins a un grup heterocíclic gran en el triptòfan.
Els aminoàcids són crítics per a la vida i tenen moltes funcions en el metabolisme. Una funció molt important és que serveixen com a blocs de construcció de les proteïnes, que són llargues cadenes lineals d'aminoàcids. Els aminoàcids poden estar units en diferents seqüències per formar una àmplia varietat de proteïnes.[4] Hi ha 22 aminoàcids que són incorporats de manera natural a polipèptids i són anomenats proteïnògens o aminoàcids estàndards. D'aquests, 20 són codificats pel codi genètic universal. Hi ha nou aminoàcids que s'anomenen «essencials» per als humans, ja que no poden ser sintetitzats a partir d'altres compostos pel cos humà, i per tant s'han d'incorporar a partir de la ingesta.
Hi ha aminoàcids que no es consideren proteics perquè no són transcripcionals, tot i que apareixen en algunes proteïnes. Aquests tipus d'aminoàcids són derivats d'altres aminoàcids (s'incorporen a la proteïna com a aminoàcids proteics) que, un cop formada la proteïna, es modifiquen químicament. Per exemple, la hidroxiprolina és una prolina a la qual s'hi ha afegit un grup hidroxil de forma post-transcripcional.
Els aminoàcids no proteics s'utilitzen com a neurotransmissors, vitamines, etc. Per exemple la beta-alanina.
Pel seu rol central en la bioquímica, els aminoàcids són importants en la nutrició i són utilitzats comunament en suplements nutricionals, en fertilitzants, en la tecnologia dels aliments i en la indústria. En la indústria les seves aplicacions inclouen la producció de plàstics biodegradables, drogues i catalitzadors quirals.
Història[modifica]
Els primers aminoàcids van ser descoberts a principis del segle xix. El 1806, els químics francesos Louis Nicolas Vauquelin i Pierre Jean Robiquet van aïllar un compost en un Asparagus que va resultar ser asparagina, el primer aminoàcid descobert.[5][6] Un altre aminoàcid que va ser descobert a principis del segle xix fou la cistina, l'any 1810,[7] encara que el seu monòmer, la cisteïna, va ser descoberta molt de temps després, el 1814.[6][8] La glicina i la leucina van ser descobertes al voltant d'aquest temps, el 1820.[9] El 1898 comença l'ús del terme aminoàcid en el llenguatge anglès.[10]
Estructura general[modifica]
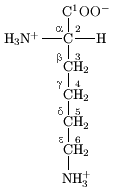
Els aminoàcids són compostos orgànics que contenen els grups funcionals amino (-NH₂) i carboxil (-COOH), així com una cadena lateral diferent en cada aminoàcid. L'àtom de carboni següent al grup carboxil s'anomena α-carboni. Els aminoàcids que tenen el grup amino unit a aquest carboni s'anomenen alfa aminoàcids. Aquesta és la forma més comuna que es troba en la natura. En els alfa aminoàcids, l'α-carboni és un àtom de carboni quiral, amb l'excepció de la glicina.[11] En els aminoàcids que tenen una cadena de carboni enllaçada a l'α-carboni (com la lisina) els carbonis s'etiqueten en ordre amb les lletres gregues α, β, γ, δ, etc. En alguns aminoàcids, el grup amino està enllaçat al β o γ-carboni, i són anomenats conseqüentment beta o gamma aminoàcids. Els aminoàcids són classificats normalment per les seves propietats o per la seva cadena lateral en quatre grups. La cadena lateral pot transformar un aminoàcid en un àcid feble o en una base feble, i hidròfil si la cadena lateral és polar o hidròfob si és apolar.
- Polars (aminoàcids sense càrrega). Gly, Ser, Thr, Cys, Tyr, Asn, Gln.
- Apolars (sense càrrega) o hidròfobs. Ala, Val, Leu, Ile, Pro, Phe, Trp, Met.
- Càrrega negativa (àcids). Asp, Glu.
- Càrrega positiva (bàsics). Lys, Arg, His.
La frase «aminoàcids de cadena ramificada» fa referència als aminoàcids que tenen cadenes laterals alifàtiques que no són lineals; els quals són la leucina, la isoleucina i la valina. La prolina és l'únic aminoàcid proteïnogen el grup lateral del qual s'enllaça a l'α-grup amino i, per tant, també és l'únic aminoàcid proteïnogen que conté un grup amino secundari en aquesta posició.[11] En termes químics, la prolina és, conseqüentment, un iminoàcid, ja que no té un grup amino primari,[12] encara que segueix classificant-se com un amino en la nomenclatura bioquímica actual,[13] i també es pot anomenar un alfa aminoàcid N-alquilat.[14]

Presència i funcions en bioquímica[modifica]
Aminoàcids estàndard[modifica]

Els aminoàcids són les unitats estructurals que integren les proteïnes. S'uneixen entre ells per formar cadenes polimèriques curtes anomenades pèptids o cadenes més llargues anomenades polipèptids o proteïnes. Aquests polímers són lineals i no ramificats, amb cadascun dels aminoàcids que integren la cadena units als dos aminoàcids veïns mitjançant un enllaç peptídic. El procés de síntesi de les proteïnes s'anomena traducció i implica l'addició pas per pas d'aminoàcids a una cadena proteica creixent mitjançant un ribozim anomenat ribosoma.[15] L'ordre en el qual els aminoàcids són afegits és llegit a través del codi genètic d'un ARNm motlle, que és un ARN còpia d'un dels gens de l'organisme.
Vint-i-dos aminoàcids són incorporats de manera natural als polipèptids i són els anomenats aminoàcids proteïnògens o naturals.[11] D'aquests, vint són codificats pel codi genètic universal. Els dos aminoàcids restants, la selenocisteïna i la pirrolisina, són incorporats a proteïnes per mecanismes sintètics específics. La selenocisteïna és incorporada quan l'ARNm que serà traduït inclou un element SECIS, que causa que el codó UGA codifiqui selenocisteïna en comptes d'un codó d'aturada.[16] La pirrolisina és usada per alguns arqueobacteris metanògens en enzims que fan servir per produir metà. Està codificada amb el codó UAG, un codó normalment d'aturada en altres organismes.[17] En els arqueobacteris, però, cal que el codó UAG vingui seguit d'una seqüència PYLIS.[18]
Àminoàcids no estàndard[modifica]
A part dels 22 aminoàcids estàndard, hi ha molts altres aminoàcids que són anomenats no proteogènics o no estàndards. Aquests o no es troben en les proteïnes (per exemple la carnitina o la GABA) o no són produïts directament i de manera aïllada per la maquinària cel·lular estàndard (per exemple, la hidroxiprolina i la selenometionina).

Els aminoàcids no estàndards que es troben en proteïnes es formen per modificacions pots-traduccionals, que són modificacions que es donen després de la traducció durant la síntesi de les proteïnes. Aquestes modificacions són molts cops essencials per a la funció o la regulació d'una proteïna. Per exemple, la carboxilació del glutamat permet que els cations de calci s'hi uneixin millor,[19] i la hidroxilació de la prolina és essencial pel manteniment del teixit connectiu.[20] Un altre exemple és la formació de la hipusina en la traducció del factor d'iniciació EIF5A, a partir de la modificació d'un residu de lisina.[21] Aquestes modificacions poden determinar també la localització de la proteïna. Per exemple, l'addició de grups hidrofòbics llargs pot causar que una proteïna s'enllaci a un fosfolípid de la membrana cel·lular.[22]
Alguns aminoàcids no estàndards no es troben en les proteïnes. Alguns exemples són la lantionina, l'àcid 2-aminoisobutíric, la dehidroalanina i el neurotransmissor anomenat àcid gamma-aminobutíric. Els aminoàcids no estàndards sovint es presenten com a intermediaris de les vies metabòliques dels aminoàcids estàndards – per exemple, l'ornitina i la citrul·lina són presents al cicle de la urea, part del catabolisme dels aminoàcids.[23] Una excepció estranya a la dominància dels alfa aminoàcids en la natura és el beta aminoàcid β-alanina (àcid 3-aminopropanoic), que utilitzen les plantes i els microorganismes en la síntesi de l'àcid pantotènic (vitamina B₅), un component del coenzim A.[24]
En la nutrició humana[modifica]
Un cop són introduïts al cos humà a través de la dieta, els 22 aminoàcids estàndard són utilitzats tant per la síntesi de proteïnes i altres biomolècules o són oxidats per a formar urea i diòxid de carboni com a font d'energia.[25] La via d'oxidació s'inicia amb l'extracció del grup amino per una transaminasa, que és introduït més tard al cicle de la urea. L'altre producte de la transaminació és un àcid cetònic que entra al cicle de l'àcid cítric.[26] Els aminoàcids glucogènics també poden ser convertits en glucosa a través de la gluconeogènesi.[27]
La presència de la pirrolisina està restringida a diversos microbis, i només un organisme té ambdós Pyl i Sec. Dels 22 aminoàcids estàndards, 9 són anomenats aminoàcids essencials perquè el cos humà no pot sintetitzar-los a partir d'altres components al nivell requerit per a un creixement normal, de manera que han de ser obtinguts per la ingesta d'aliments.[28] A més a més, la cisteïna, la taurina, la tirosina, la histidina i l'arginina són aminoàcids semiessencials en nens, ja que les vies metabòliques que sintetitzen aquests aminoàcids no estan plenament desenvolupades.[29][30] Les quantitats requerides també depenen de l'edat i la salut de l'individu, de manera que és difícil determinar quins són els requisits alimentaris generals d'alguns aminoàcids.
| Essencial | No essencial |
|---|---|
| Isoleucina | Alanina |
| Leucina | Asparagina |
| Lisina | Àcid aspàrtic |
| Metionina | Cisteïna* |
| Fenilalanina | Àcid glutàmic |
| Treonina | Glutamina* |
| Triptòfan | Glicina* |
| Valina | Prolina* |
| Histidina | Selenocisteïna* |
| Serina* | |
| Tirosina* | |
| Arginina* | |
| Ornitina* | |
| Taurina* |
(*) Essencials només en certs casos.[31][32]
Funcions no proteiques dels aminoàcids[modifica]
En humans, els aminoàcids que no formen proteïnes també tenen un paper important com a intermediaris en el metabolisme, com per exemple en la biosíntesi del neurotransmissor àcid gamma-aminobutíric. Alguns aminoàcids són emprats en la síntesi d'altres molècules, com per exemple:
- El triptòfan és un precursor del neurotransmissor serotonina.[33]
- La tirosina és un precursor del neurotransmissor dopamina.
- La glicina és un precursor de porfirines com per exemple el grup hemo.[34]
- L'arginina és un precursor de l'òxid nítric.[35]
- L'ornitina i la S-adenosilmetionina (SAM) són precursors de poliamines.[36]
- L'aspartat, la glicina i la glutamina són precursors de nucleòtids.[37]
- La fenilalanina és un precursor de diversos fenilpropanoids, que són importants en el metabolisme.
Això no obstant, no totes les funcions d'altres aminoàcids no estàndards abundants són coneguts. Per exemple, la taurina és un aminoàcid predominant en els teixits musculars i del cervell, però, malgrat que s'han proposat moltes funcions que podria desenvolupar, encara no s'ha precisat el seu paper en el cos.[38]
Alguns aminoàcids no estàndards són usats per algunes plantes com a defensa contra els herbívors.[39] Per exemple, la canavanina és un anàleg de l'arginina que es troba en molts llegums[40] i en quantitats particularment importants en la Canavalia gladiata (espasa de fesol).[41] Aquest aminoàcid protegeix les plantes de depredadors com els insectes i pot causar malalties en els humans si alguns tipus de llegums són ingerides sense un processament previ.[42] L'aminoàcid no estàndard mimosina es troba en altres espècies de llegums, particularment la Leucaena leucocephala.[43] Aquest compost és un anàleg de la tirosina i pot enverinar animals que s'alimenten d'aquestes plantes.
Propietats fisicoquímiques dels aminoàcids[modifica]
Els 20 aminoàcids codificats directament pel codi genètic poden ser dividits en diferents grups basant-nos en les seves propietats. Els factors més importants són la càrrega, la hidrofília o hidrofòbia, la mida i els grups funcionals.[11]
Àcido-bàsiques[modifica]
Comportament de qualsevol aminoàcid quan s'ionitza. Qualsevol aminoàcid pot comportar-se com a àcid o base (són amfòters) depenent del pH del medi i de la Ka de l'àminoàcid.
Els aminoàcids i proteïnes es comporten com substàncies tampons. Quan una molècula presenta càrrega neta zero es troba en el punt isoelèctric.
Zwitterions[modifica]

Els grups funcionals amino i carboxil trobats en els aminoàcids els permeten tenir propietats amfipròtiques.[11] Els grups carboxil (-CO₂H) poden ser desprotonats per esdevenir carboxilats amb càrrega negativa (-CO₂-), i els grups α-amino (NH₂-) poden ser protonats per esdevenir grups α-amoni amb càrrega positiva (+NH₃-). A valors de pH majors que el pKa del grup carboxil (tenint en compte que la mitjana pels 20 aminoàcids comuns és de 2.2, veure la taula d'estructures d'aminoàcids a la part superior), l'ió carboxilat negatiu predomina. A valors de pH inferiors que el pKa del grup α-amoni (la mitjana pels 20 α-aminoàcids comuns és de 9.4), el nitrogen és predominantment protonat donant lloc a un grup α-amoni positivament carregat. Així doncs, a un pH entre 2.2 i 9.4, la forma predominant adoptada pels alfa aminoàcids conté un grup carboxilat negatiu i un grup α-amoni positiu, tal com es mostra en l'estructura (2) a la dreta, donant a l'aminoàcid una càrrega total neta igual a zero.
Aquest estat molecular és conegut com a zwitterió, de l'alemany “Zwitter” hermafrodita o híbrid.[44] Sota valors de pH 2.2, la forma predominant tindrà un grup carboxil neutre i un grup positiu d'ió α-amoni (càrrega neta +1) i per sobre de valors de pH 9.4, un grup carboxilat negatiu i grup neutre α-amino (càrrega neta -1). La forma plenament neutra (estructura (1) a la dreta) és una espècie molt minoritària en solució aquosa en tot el rang de pH (trobem menys d'una part per cada 107). Els aminoàcids també existeixen com a zwitterions en fase sòlida i cristal·litzen amb propietats pròpies de les sals, a diferència dels àcids orgànics típics o les amines.
Punt Isoelèctric[modifica]
A valors de pH que es troben entre el dos pKa (del carboxil i de l'amina), el zwitterió predomina, però coexisteix en un equilibri dinàmic amb quantitats petites d'ions positius i negatius amb càrrega neta. En el punt exacte entre els dos pKa, la quantitat d'ió net negatiu i d'ió net positiu és exactament igual, de manera que la càrrega neta mitjana de totes les formes presents és zero.[45] Aquest pH és conegut com el punt isoelèctric pI, sent pI = ½(pKa1 + pKa₂).
Cadascun dels aminoàcids per separat té un valor pKa lleugerament diferent de la resta, de manera que també té un punt isoelèctric diferent. Per aminoàcids amb cadenes laterals carregades, el pKa de la cadena té implicació en el pI. Així doncs, per aminoàcids com l'àcid aspàrtic o l'àcid glutàmic amb cadenes laterals carregades negativament, el punt isoelèctric ve donat per pI = ½(pKa1 + pKaR), on pKaR correspon al pKa de la cadena lateral. La cisteïna també té una cadena lateral negativament carregada amb un pKaR = 8.14, de manera que el pI hauria de ser calculat de la mateixa manera que per l'Asp i l'Glu, tot i que la cadena lateral no es troba significativament carregada a pH neutre. Per la histidina, la lisina i l'arginina, aminoàcids amb cadenes laterals positivament carregades, el pI serà: pI = ½(pKaR + pKa₂).
Els aminoàcids no tenen mobilitat durant electroforesi si es troben en el seu punt isoelèctric descrit anteriorment, tot i que aquest comportament es veu més evidenciat en pèptids i proteïnes que no pas en aminoàcids sols. Els zwitterions tenen una solubilitat mínima en el seu punt isoelèctric i alguns aminoàcids (amb cadenes laterals no polars, en particular) poden ser aïllats per precipitació en aigua ajustant el pH al requerit per al punt isoelèctric.
Òptiques[modifica]

Isomerisme[modifica]
Dels alfa aminoàcids tots menys la glicina poden existir en qualsevol dels dos isòmers òptics, anomenats L o D aminoàcids, els quals són imatges especulars l'un de l'altre. Mentre que els L-aminoàcids representen tots els aminoàcids que es troben en les proteïnes durant la traducció en el ribosoma, els D-aminoàcids es troben en algunes proteïnes produïdes per modificacions post- traduccionals enzimàtiques, després de la traducció i la translocació al reticle endoplasmàtic, com també en organismes exòtics que habiten al mar, com les espècies de Conus.[46] També són abundants en components com els peptidoglicans de la paret cel·lular dels bacteris[47] i la D-serina podria actuar com un neurotransmissor en el cervell.[48] La convenció L o D per a la configuració d'un aminoàcid no es refereix a l'activitat òptica de l'aminoàcid en si, sinó a l'activitat òptica de l'isòmer de gliceraldehid del qual, en teoria, pot sintetitzar-se (D-gliceraldehid és dextrogir i L-gliceraldehid és levogir). De manera alternativa, els designadors (S) i (R) es fan servir per indicar l'estereoquímica absoluta. Gairebé tots els aminoàcids en proteïnes són (S) en el α-carboni, sent la cisteïna (R) i la glicina no quiral.[49] La cisteïna és inusual, ja que té un àtom de sofre en la segona posició de la seva cadena lateral, la qual té una massa atòmica superior que els grups enllaçats al primer carboni, que s'uneix al α-carboni en els altres aminoàcids estàndards, de manera que és (R) en lloc de (S).
Químiques[modifica]
- Les que afecten el grup carboxil (descarboxilació).
- Les que afecten el grup amino (desaminació).
- Les que afecten el radical.
Importància[modifica]
Aquestes propietats són importants per l'estructura de la proteïna i la interacció proteïna-proteïna. Les proteïnes hidrosolubles solen tenir residus hidrofòbics (Leu, Ile, Val, Phe i Trp) situats enmig de la proteïna, mentre que les cadenes laterals hidròfiles estan exposades a l'aigua. Les proteïnes integrals de membrana solen tenir anells externs amb aminoàcids hidròfobs que serveixen d'ancoratge a la bicapa lipídica. Algunes proteïnes perifèriques de la membrana tenen una regió amb aminoàcids hidrofòbics en la seva superfície que les uneix a la membrana. De manera semblant, les proteïnes que han d'unir-se a molècules carregades positivament tenen una superfície rica en càrregues negatives amb aminoàcids com el glutamat o l'àcid aspàrtic; mentre que les proteïnes que s'han d'unir a molècules carregades negativament tenen una superfície rica en càrregues positives amb aminoàcids com la lisina o l'arginina. Hi ha diferents escales d'hidrofòbia de residus aminoacídics.[50]
Alguns aminoàcids tenen propietats especials com la cisteïna, que pot formar enllaços covalents disulfur amb altres residus de cisteïna; la prolina, que forma un compost cíclic; o la glicina que és més flexible que altres aminoàcids.
Moltes proteïnes pateixen una sèrie de modificacions post-traduccionals que consisteixen en l'adhesió de grups funcionals en aminoàcids d'una proteïna. Algunes modificacions poden produir lipoproteïnes[51] hidròfobes o glicoproteïnes hidròfiles.[52] Aquest tipus de modificació permet el canvi d'orientació d'una proteïna en la membrana. Per exemple, l'adhesió o eliminació de l'àcid palmític, que és un àcid gras, a residus de cisteïna en algunes proteïnes senyal, causa la unió o separació d'aquestes proteïnes a la membrana.[53]
Taula d'abreviacions i propietats dels aminoàcids estàndards[modifica]
| Aminoàcid | Codi de 3 lletres[54] | Codi d'1 lletra[54] | Polaritat de la cadena lateral[54] | Càrrega de la cadena lateral (pH 7.4)[54] | Índex hidropàtic[55] | Absorbància λmax(nm)[56] | ε en λmax (x10−3 M−1 cm−1)[56] |
|---|---|---|---|---|---|---|---|
| Alanina | Ala | A | no polar | neutra | 1.8 | ||
| Arginina | Arg | R | polar | positiva | −4.5 | ||
| Asparagina | Asn | N | polar | neutra | −3.5 | ||
| Àcid aspàrtic | Asp | D | polar | negativa | −3.5 | ||
| Cisteïna | Cys | C | polar | neutra | 2.5 | 250 | 0.3 |
| Àcid glutàmic | Glu | E | polar | negativa | −3.5 | ||
| Glutamina | Gln | Q | polar | neutra | −3.5 | ||
| Glicina | Gly | G | no polar | neutra | −0.4 | ||
| Histidina | His | H | polar | positiva(10%)
neutra(90%) |
−3.2 | 211 | 5.9 |
| Isoleucina | Ile | I | no polar | neutra | 4.5 | ||
| Leucina | Leu | L | no polar | neutra | 3.8 | ||
| Lisina | Lys | K | polar | positiva | −3.9 | ||
| Metionina | Met | M | no polar | neutra | 1.9 | ||
| Fenilalanina | Phe | F | no polar | neutra | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 |
| Prolina | Pro | P | no polar | neutra | −1.6 | ||
| Serina | Ser | S | polar | neutra | −0.8 | ||
| Treonina | Thr | T | polar | neutra | −0.7 | ||
| Triptòfan | Trp | W | no polar | neutra | −0.9 | 280, 219 | 5.6, 47.0 |
| Tirosina | Tyr | Y | polar | neutra | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 |
| Valina | Val | V | no polar | neutra | 4.2 |
A més, hi ha dos aminoàcids més que són incorporats per codons d'aturada primordials:
| 21è i 22è aminoàcids | Codi de 3 lletres | Codi d'1 lletra |
|---|---|---|
| Selenocisteïna | Sec | U |
| Pirrolisina | Pyl | O |
A més dels codis d'aminoàcids específics, els marcadors de posició s'utilitzen en els casos en què l'anàlisi química o cristal·logràfica d'un pèptid o d'una proteïna no pot determinar de manera concloent la identitat d'un residu.
| Aminoàcids ambigus | Codi de 3 lletres | Codi d'1 lletra |
|---|---|---|
| Asparagina oa àcid aspàrtic | Asx | B |
| Glutamina o Àcid glutàmic | Glx | Z |
| Leucina o Isoleucina | Xle | J |
| Aminoàcids no específicats o desconeguts (Unk) | Xaa | X |
Unk s'utilitza a vegades en lloc de Xaa, però és menys estàndard.
A més, molts aminoàcids no estàndards tenen un codi específic. Per exemple, diversos fàrmacs peptídics, com el Bortezomib i el MG132, són sintetiitzats artificialment i mantenen els seus grups protectors, que tenen codis específics. El Bortezomib és Pyz-Phe-boroLeu, i el MG132 és is Z-Leu-Leu-Leu-al.[57]
Reaccions[modifica]
Com que els aminoàcids tenen tant un grup amino primari, com un grup carboxil primari, aquests compostos químics poden patir la majoria de les reaccions associades a aquests grups funcionals. Aquests inclouen l'addició nucleofílica, la formació de l'enllaç amida i la formació d'imina pel grup amino i l'esterificació, la formació de l'enllaç amida i la descarboxilació del grup àcid carboxílic.[58] La combinació d'aquests grups funcionals permet als aminoàcids ser lligants multidentats efectius d'aminoàcids metàl·lics quelats.[59] Les múltiples cadenes laterals dels aminoàcids també poden patir reaccions químiques.[60] Els tipus d'aquestes reaccions estan determinats pels grups que hi ha en aquestes cadenes laterals i són, per tant, diferents entre els diversos tipus d'aminoàcids.
Síntesi química[modifica]
Existeixen diferents mètodes per sintetitzar aminoàcids. Un dels més antics comença amb l'halogenació de Hell-Volhard-Zelinsky al carboni α d'un àcid carboxílic. Després, la substitució nucleofílica amb amoníac, converteix l'alquil bromur a aminoàcid.[61] De manera alternativa, la Síntesi dels aminoàcids de Strecker comporta el tractament d'un aldehid amb cianur de potassi i amoníac; això produeix un α-aminonitril com a intermediari.

Tot seguit, la hidròlisi del nitril produeix un alfa aminoàcid.[62] L'ús d'amoni o amoníac en aquesta reacció dona lloc a aminoàcids no-substituïts, mentre que substituint amines primàries o secundàries es produiran aminoàcids substituïts.[63] De la mateixa manera, l'ús de cetones en comptes d'aldehids, dona lloc a aminoàcids α,α-disubstituïts.[64] La síntesi clàssica dona lloc a una mescla racèmica d'alfa aminoàcids com a productes, però han estat desenvolupats gran quantitat de procediments emprant auxiliars asimètrics[65] o catalitzadors asimètrics.[66][67][68]
A la vegada, el mètode més utilitzat és una síntesi automatitzada en un suport sòlid (per exemple llits de poliestirè), utilitzant grups protectors (per exemple Fmoc i t-Boc) i grups activadors (per exemple DCC i DIC).
Biosíntesi[modifica]
En les plantes, el nitrogen és assimilat primer a compostos orgànics en forma de glutamat, format a partir d'alfa-cetoglutarat i amoníac en el mitocondri. Per formar altres aminoàcids, la planta utilitza transaminases per moure el grup amino a un altre alfa-ceto carboxílic. Per exemple, l'aspartat aminotransferasa converteix el glutamat i l'oxalacetat a alfa-cetoglutarat i aspartat.[69] Altres organismes també utilitzen les transaminases per a la síntesi d'aminoàcids.
Els aminoàcids no estàndards es formen generalment a partir de modificacions dels aminoàcids estàndards. Per exemple, l'homocisteïna es forma a través de la via de transulfuració o per la desmetilació de la metionina a través del metabòlit intermedi S–adenosil metionina,[38] mentre que en la hidroxiprolina es realitza una modificació post-traduccional de la prolina.[70]
Els microorganismes i les plantes poden sintetitzar molts aminoàcids poc freqüents. Per exemple, alguns microbis sintetitzen àcid 2-aminoisobutíric i lantionina, que és un derivat de l'alanina amb un sofre de pont. Aquests dos aminoàcids es troben en lantibiòtics peptídics com l'alameticina.[71] Mentre que en les plantes, l'1-aminociclopropà-1–carboxílic és un aminoàcid cíclic disubstituït petit que és un intermediari clau en la producció de l'hormona etilè de la planta.[72]
Formació de l'enllaç peptídic[modifica]
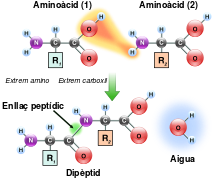
Així com els grups amino i carboxil dels aminoàcids poden reaccionar per formar enllaços amida, una molècula d'aminoàcid pot reaccionar amb una altra per formar un enllaç amida que les uneixi. La polimerització dels aminoàcids és precursora de les proteïnes. Aquesta reacció de condensació produeix l'enllaç peptídic recentment format i una molècula d'aigua. En les cèl·lules, aquesta reacció no succeeix directament; en lloc d'això, l'aminoàcid és activat per la unió a una molècula d'RNA de transferència per mitjà d'un enllaç èster.[73] Aquest aminoacil-tRNA és produït en una reacció dependent de trifosfat d'adenosina, duta a terme per un aminoacil tRNA sintetasa. Tot seguit, aquest aminoacil-tRNA és el substrat per a un ribosoma que catalitza un atac vers el grup amino de la cadena proteica sobre l'enllaç èster.[74] Com a conseqüència d'aquest mecanisme, totes les proteïnes sintetitzades per un ribosoma tenen l'inici a l'extrem amino i el final a l'extrem carboxil.
De tota manera, no tots els enllaços peptídics es formen així. A vegades, els pèptids són sintetitzats per enzims específics. Per exemple, el tripèptid glutatió, que és una part essencial de les defenses de la cèl·lula contra l'estrès d'oxidació, és sintetitzat en dos passos emprant aminoàcids lliures.[75] En el primer pas, la gamma-glutamilcisteïna-sintetasa condensa la cisteïna i l'àcid glutàmic a través d'un enllaç peptídic format pel carboxil de la cadena lateral del glutamat (el carboni gamma d'aquesta cadena lateral) i el grup amino de la cisteïna. Després, aquest dipèptid és condensat amb una glicina per la glutatió sintetasa fins a arribar a la forma glutatió.[76]
En química, els pèptids són sintetitzats per una varietat de reaccions. Una de les més emprades en síntesi de pèptids en fase sòlida utilitza els derivats aromàtics de l'oxima dels aminoàcids com a unitats actives. Aquests són adherits en seqüència a la cadena peptídica, que es troba unida a un suport sòlid de resina.[77] La facilitat per sintetitzar un gran nombre de pèptids diferents simplement variant el tipus i l'ordre dels aminoàcids (per mitjà de química combinacional) ha permès que aquesta síntesi esdevingui un fet important en la creació de llibreries de pèptids per usar en recerca farmacèutica mitjançant el cribratge d'alt rendiment.[78]
Catabolisme[modifica]
La degradació d'aminoàcids sovint implica una desaminació que consisteix a desplaçar el grup amino a un α-cetoglutarat, que forma glutamat. Aquest procés necessita l'acció de transaminases que solen ser les mateixes que s'han utilitzat en l'aminació durant la síntesi. En la majoria de vertebrats, el grup amino és suprimit pel cicle de la urea i secretat en forma d'urea. Tot i així, la degradació dels aminoàcids pot produir àcid úric o amoníac en comptes d'urea. Per exemple, la serina deshidratasa converteix la serina en piruvat i amoníac.[79]
Usos en la tecnologia[modifica]
Els aminoàcids tenen una extensa varietat d'aplicacions en la indústria, però el seu ús principal és com a additiu en menjar per a animals. Aquesta funció és important, ja que molts dels components majoritaris d'aquests aliments, com la soja, o tenen nivells baixos dels aminoàcids essencials o no tenen alguns d'aquests aminoàcids. La lisina,la metionina, la treonina i el triptòfan són els aminoàcids més importants en la producció d'aquests aliments.[80] En aquesta indústria, els aminoàcids també són emprats en quelats per tal de millorar l'absorció de minerals dels suplements, que poden ser necessaris per millorar la salut o la producció d'aquests animals.[81]
La indústria alimentària és un consumidor majoritari d'aminoàcids, en particular de l'àcid glutàmic, que s'utilitza com un potenciador del sabor,[82] i de l'aspartam (aspartil-fenilalanina–1-metil ester) com un edulcorant artificial baix en calories.[83] Una tecnologia similar a la utilitzada en la nutrició animal s'empra en la indústria nutricional humana per alleujar la deficiènica de minerals, com l'anèmia, mitjançant la millora de l'absorció de minerals i reduint els efectes secundaris negatius dels suplements de minerals inorgànics.[84]
La capacitat quelant dels aminoàcids ha estat utilitzada en fertilitzants per a l'agricultura per facilitar el subministrament de minerals a les plantes per tal de corregir les deficiències de minerals, com ara la clorosi fèrrica. Aquests fertilitzants també són utilitzats per evitar que es produeixin deficiències i millorar la salut general de les plantes.[85] La resta de la producció d'aminoàcids s'utilitza en la síntesi de fàrmacs i cosmètics.[80]
| Derivat de l'aminoàcid | Aplicació farmacèutica |
|---|---|
| 5-HTP (5-hidroxitriptofan) | Tractament experimental per a la depressió.[86] |
| L-DOPA (L-dihidroxifenilalanina) | Tractament per a la malaltia de Parkinson.[87] |
| Eflornitina | Fàrmac que inhhibeix la ornitina descarboxilasa i s'utilitza en el tractament de la malaltia de la son.[88] |
Codi genètic ampliat[modifica]
Des de l'any 2011, 40 aminoàcids no naturals han estat afegits a una proteïna mitjançant la creació d'un codó únic i el seu corresponent ARN de transferència: la parella aminoacil- tRNA- sintetasa per a codificar amb diverses propietats fisicoquímiques i biològiques per tal de ser utilitzat com una eina per explorar l'estructura de les proteïnes i la seva funció o bé per crear noves o millors proteïnes.[89][90]
Components químics bàsics[modifica]
Els aminoàcids són importants com a matèries primeres de baix cost. Aquests compostos són utilitzats en la síntesi asimètrica com a blocs de construcció enantiomèricament purs.[91]
Els aminoàcids s'han investigat com a precursors de catalitzadors quirals, com per exemple per a reaccions d'hidrogenació asimètrica, encara que no existeixen aplicacions comercials.[92]
Els plàstics biodegradables[modifica]
Els aminoàcids estan en fase de desenvolupament com a components d'una extensa gamma de polímers biodegradables. Aquests materials tenen aplicacions com a embalatges ecològics, i en medicina en l'administració de fàrmacs i la construcció dels implants de pròtesis. Aquests polímers són polipèptids, poliamides, polièsters, polisulfurs i poliuretans amb aminoàcids que o bé formen part de les seves cadenes principals o bé estant units a ells com a cadenes laterals. Aquestes modificacions alteren les propietats físiques i la reactivitat dels polímers.[93] Un exemple interessant d'aquests materials és el poliaspartat, un polímer biodegradable i hidrosoluble que pot tenir aplicacions en la fabricació de bolquers i en l'agricultura.[94] A causa de la seva solubilitat i capacitat de formar quelats d'ions metàl·lics, el poliaspartat s'utilitza també com a agent biodegradable contra l'escalament i com a inhibidor de la corrosió.[95][96] A més, l'aminoàcid aromàtic tirosina s'està desenvolupant com a possible substitut de fenols tòxics com el bisfenol A en la fabricació de policarbonats.[97]
Vegeu també[modifica]
Referències[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Aminoàcid |
- ↑ Wagner I, Musso H «New Naturally Occurring Amino Acids». Angew. Chem. Int. Ed. Engl., 22, 22, Novembre 1983, pàg. 816–828. DOI: 10.1002/anie.198308161.
- ↑ «Human nutrition in the developing world» (en anglès). Organització de les Nacions Unides per a l'Agricultura i l'Alimentació. [Consulta: 2 juny 2015].
- ↑ La prolina és una excepció a aquesta fórmula general. No té el grup NH₂ ja que la cadena lateral es cicla i és conegut com un iminoàcid; cau en la categoria d'aminoàcids amb etsructures especials.
- ↑ «The Structures of Life». National Institute of General Medical Sciences. Arxivat de l'original el 2014-06-07. [Consulta: 20 maig 2008].
- ↑ Vauquelin LN, Robiquet PJ «The discovery of a new plant principle in Asparagus sativus». Annales de Chimie, 57, 1806, pàg. 88–93.
- ↑ 6,0 6,1 Anfinsen CB, Edsall JT, Richards FM. Advances in Protein Chemistry. Nova York: Academic Press, 1972, p. 99, 103. ISBN 978-0-12-034226-6.
- ↑ Wollaston WH «On cystic oxide, a new species of urinary calculus». Philosophical Transactions of the Royal Society of London, 100, 0, 1810, pàg. 223–30. DOI: 10.1098/rstl.1810.0015.
- ↑ Baumann E «Über cystin und cystein». Z Physiol Chemie, 8, 4, 1884, pàg. 299–305 [Consulta: 28 març 2011].
- ↑ Braconnot HM «Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique». Ann Chim Phys Ser 2, 13, 1820, pàg. 113–25.
- ↑ «etymonline.com entry for amino». www.etymonline.com. Arxivat de l'original el 2012-10-20. [Consulta: 19 juliol 2010].
- ↑ 11,0 11,1 11,2 11,3 11,4 Creighton, Thomas H. «Chapter 1». A: Proteins: structures and molecular properties. San Francisco: W. H. Freeman, 1993. ISBN 978-0-7167-7030-5.
- ↑ Jodidi, S. L. «The Formol Titration of Certain Amino Acids». Journal of the American Chemical Society, 48, 3, 01-03-1926, pàg. 751–753. DOI: 10.1021/ja01414a033.
- ↑ Liebecq, Claude. Biochemical Nomenclature and Related Documents. 2a edició. Portland Press, 1992, p. 39–69. ISBN 978-1-85578-005-7.
- ↑ Smith, Anthony D. Oxford dictionary of biochemistry and molecular biology. Oxford: Oxford University Press, 1997, p. 535. ISBN 978-0-19-854768-6. OCLC 37616711.
- ↑ Rodnina MV, Beringer M, Wintermeyer W «How ribosomes make peptide bonds». Trends in Biochemical Sciences, 32, 1, gener 2007, pàg. 20–6. DOI: 10.1016/j.tibs.2006.11.007. PMID: 17157507.
- ↑ Driscoll DM, Copeland PR «Mechanism and regulation of selenoprotein synthesis». Annual Review of Nutrition, 23, 1, 2003, pàg. 17–40. DOI: 10.1146/annurev.nutr.23.011702.073318. PMID: 12524431.
- ↑ Krzycki JA «The direct genetic encoding of pyrrolysine». Current Opinion in Microbiology, 8, 6, desembre 2005, pàg. 706–12. DOI: 10.1016/j.mib.2005.10.009. PMID: 16256420.
- ↑ Théobald-Dietrich A, Giegé R, Rudinger-Thirion J «Evidence for the existence in mRNAs of a hairpin element responsible for ribosome dependent pyrrolysine insertion into proteins». Biochimie, 87, 9–10, 2005, pàg. 813–7. DOI: 10.1016/j.biochi.2005.03.006. PMID: 16164991.
- ↑ Vermeer C «Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase». The Biochemical Journal, 266, 3, març 1990, pàg. 625–36. PMC: 1131186. PMID: 2183788.
- ↑ Bhattacharjee A, Bansal M «Collagen structure: the Madras triple helix and the current scenario». IUBMB Life, 57, 3, març 2005, pàg. 161–72. DOI: 10.1080/15216540500090710. PMID: 16036578.
- ↑ Park MH «The post-translational synthesis of a polyamine-derived amino acid, hypusine, in the eukaryotic translation initiation factor 5A (eIF5A)». Journal of Biochemistry, 139, 2, febrer 2006, pàg. 161–9. DOI: 10.1093/jb/mvj034. PMC: 2494880. PMID: 16452303.
- ↑ Blenis J, Resh MD «Subcellular localization specified by protein acylation and phosphorylation». Current Opinion in Cell Biology, 5, 6, desembre 1993, pàg. 984–9. DOI: 10.1016/0955-0674(93)90081-Z. PMID: 8129952.
- ↑ Curis E, Nicolis I, Moinard C, et al. «Almost all about citrulline in mammals». Amino Acids, 29, 3, novembre 2005, pàg. 177–205. DOI: 10.1007/s00726-005-0235-4. PMID: 16082501.
- ↑ Coxon KM, Chakauya E, Ottenhof HH, et al. «Pantothenate biosynthesis in higher plants». Biochemical Society Transactions, 33, Pt 4, agost 2005, pàg. 743–6. DOI: 10.1042/BST0330743. PMID: 16042590.
- ↑ Sakami W, Harrington H «Amino acid metabolism». Annual Review of Biochemistry, 32, 1, 1963, pàg. 355–98. DOI: 10.1146/annurev.bi.32.070163.002035. PMID: 14144484.
- ↑ Brosnan JT «Glutamate, at the interface between amino acid and carbohydrate metabolism». The Journal of Nutrition, 130, 4S Suppl, abril 2000, pàg. 988S–90S. PMID: 10736367.
- ↑ Young VR, Ajami AM «Glutamine: the emperor or his clothes?». The Journal of Nutrition, 131, 9 Suppl, setembre 2001, pàg. 2449S–59S; discussion 2486S–7S. PMID: 11533293.
- ↑ Young VR «Adult amino acid requirements: the case for a major revision in current recommendations». The Journal of Nutrition, 124, 8 Suppl, agost 1994, pàg. 1517S–1523S. PMID: 8064412.
- ↑ Imura K, Okada A «Amino acid metabolism in pediatric patients». Nutrition, 14, 1, gener 1998, pàg. 143–8. DOI: 10.1016/S0899-9007(97)00230-X. PMID: 9437700.
- ↑ Lourenço R, Camilo ME «Taurine: a conditionally essential amino acid in humans? An overview in health and disease». Nutrición Hospitalaria, 17, 6, 2002, pàg. 262–70. PMID: 12514918.
- ↑ Fürst P, Stehle P «What are the essential elements needed for the determination of amino acid requirements in humans?». The Journal of Nutrition, 134, 6 Suppl, juny 2004, pàg. 1558S–1565S. PMID: 15173430.
- ↑ Reeds PJ «Dispensable and indispensable amino acids for humans». The Journal of Nutrition, 130, 7, juliol 2000, pàg. 1835S–40S. PMID: 10867060.
- ↑ Savelieva KV, Zhao S, Pogorelov VM, et al. «Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants». PloS ONE. Bartolomucci, Alessandro, 3, 10, 2008, pàg. e3301. Bibcode: 2008PLoSO...3.3301S. DOI: 10.1371/journal.pone.0003301. PMC: 2565062. PMID: 18923670.
- ↑ Shemin D, Rittenberg D «The biological utilization of glycine for the synthesis of the protoporphyrin of hemoglobin». Journal of Biological Chemistry, 166, 2, 01-12-1946, pàg. 621–5. PMID: 20276176.
- ↑ Tejero J, Biswas A, Wang ZQ, et al. «Stabilization and characterization of a heme-oxy reaction intermediate in inducible nitric-oxide synthase». The Journal of Biological Chemistry, 283, 48, novembre 2008, pàg. 33498–507. DOI: 10.1074/jbc.M806122200. PMC: 2586280. PMID: 18815130.
- ↑ Rodríguez-Caso C, Montañez R, Cascante M, Sánchez-Jiménez F, Medina MA «Mathematical modeling of polyamine metabolism in mammals». The Journal of Biological Chemistry, 281, 31, agost 2006, pàg. 21799–812. DOI: 10.1074/jbc.M602756200. PMID: 16709566.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L.. Biochemistry. San Francisco: W.H. Freeman, 2002, p. 693–8. ISBN 0-7167-4684-0.
- ↑ 38,0 38,1 Brosnan JT, Brosnan ME «The sulfur-containing amino acids: an overview». The Journal of Nutrition, 136, 6 Suppl, juny 2006, pàg. 1636S–1640S. PMID: 16702333.
- ↑ Hylin, John W. «Toxic peptides and amino acids in foods and feeds». Journal of Agricultural and Food Chemistry, 17, 3, 1969, pàg. 492–6. DOI: 10.1021/jf60163a003.
- ↑ Turner, B. L.; Harborne, J. B. «Distribution of canavanine in the plant kingdom». Phytochemistry, 6, 6, 1967, pàg. 863–66. DOI: 10.1016/S0031-9422(00)86033-1.
- ↑ Ekanayake S, Skog K, Asp NG «Canavanine content in sword beans (Canavalia gladiata): analysis and effect of processing». Food and Chemical Toxicology, 45, 5, maig 2007, pàg. 797–803. DOI: 10.1016/j.fct.2006.10.030. PMID: 17187914.
- ↑ Rosenthal GA «L-Canavanine: a higher plant insecticidal allelochemical». Amino Acids, 21, 3, 2001, pàg. 319–30. DOI: 10.1007/s007260170017. PMID: 11764412.
- ↑ Hammond AC «Leucaena toxicosis and its control in ruminants». Journal of Animal Science, 73, 5, maig 1995, pàg. 1487–92. PMID: 7665380.[Enllaç no actiu]
- ↑ Simmons, William J.; Gerhard Meisenberg. Principles of medical biochemistry. Mosby Elsevier, 2006, p. 19. ISBN 0-323-02942-6.
- ↑ Fennema OR. Food Chemistry 3rd Ed. CRC Press, p. 327–8. ISBN 0-8247-9691-8.
- ↑ Pisarewicz K, Mora D, Pflueger FC, Fields GB, Marí F «Polypeptide chains containing D-gamma-hydroxyvaline». Journal of the American Chemical Society, 127, 17, maig 2005, pàg. 6207–15. DOI: 10.1021/ja050088m. PMID: 15853325.
- ↑ Van Heijenoort, J «Formation of the glycan chains in the synthesis of bacterial peptidoglycan». Glycobiology, 11, 3, març 2001, pàg. 25R–36R. DOI: 10.1093/glycob/11.3.25R. PMID: 11320055.
- ↑ Wolosker H, Dumin E, Balan L, Foltyn VN «D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration». The FEBS Journal, 275, 14, juliol 2008, pàg. 3514–26. DOI: 10.1111/j.1742-4658.2008.06515.x. PMID: 18564180.
- ↑ Hatem, Salama Mohamed Ali. «Gas chromatographic determination of Amino Acid Enantiomers in tobacco and bottled wines». University of Giessen, 2006. [Consulta: 17 novembre 2008].
- ↑ Urry, Dan W. «The change in Gibbs free energy for hydrophobic association: Derivation and evaluation by means of inverse temperature transitions». Chemical Physics Letters, 399, 1–3, 2004, pàg. 177–83. DOI: 10.1016/S0009-2614(04)01565-9.
- ↑ Magee T, Seabra MC «Fatty acylation and prenylation of proteins: what's hot in fat». Current Opinion in Cell Biology, 17, 2, abril 2005, pàg. 190–6. DOI: 10.1016/j.ceb.2005.02.003. PMID: 15780596.
- ↑ Pilobello KT, Mahal LK «Deciphering the glycocode: the complexity and analytical challenge of glycomics». Current Opinion in Chemical Biology, 11, 3, juny 2007, pàg. 300–5. DOI: 10.1016/j.cbpa.2007.05.002. PMID: 17500024.
- ↑ Smotrys JE, Linder ME «Palmitoylation of intracellular signaling proteins: regulation and function». Annual Review of Biochemistry, 73, 1, 2004, pàg. 559–87. DOI: 10.1146/annurev.biochem.73.011303.073954. PMID: 15189153.
- ↑ 54,0 54,1 54,2 54,3 Hausman, Robert E.; Cooper, Geoffrey M.. The cell: a molecular approach. Washington, D.C: ASM Press, 2004, p. 51. ISBN 0-87893-214-3.
- ↑ Kyte J, Doolittle RF «A simple method for displaying the hydropathic character of a protein». Journal of Molecular Biology, 157, 1, maig 1982, pàg. 105–32. DOI: 10.1016/0022-2836(82)90515-0. PMID: 7108955.
- ↑ 56,0 56,1 Freifelder, D.. Physical Biochemistry. 2a ed.. W. H. Freeman and Company, 1983. ISBN 0-7167-1315-2.
- ↑ Suchanek M, Radzikowska A, Thiele C «Photo-leucine and photo-methionine allow identification of protein-protein interactions in living cells». Nature Methods, 2, 4, abril 2005, pàg. 261–7. DOI: 10.1038/nmeth752. PMID: 15782218.
- ↑ Elmore, Donald Trevor; Barrett, G. C.. Amino acids and peptides. Cambridge, UK: Cambridge University Press, 1998, p. 48–60. ISBN 0-521-46827-2.
- ↑ Konar, Sanjit [et al]. «Structural determination and characterization of copper and zinc bis-glycinates with X-ray crystallography and mass spectrometry». Journal of Coordination Chemistry, 63, 19, 2010.
- ↑ Gutteridge A, Thornton JM «Understanding nature's catalytic toolkit». Trends in Biochemical Sciences, 30, 11, novembre 2005, pàg. 622–9. DOI: 10.1016/j.tibs.2005.09.006. PMID: 16214343.
- ↑ McMurry, John. Organic chemistry. Pacific Grove, CA, USA: Brooks/Cole, 1996, p. 1064. ISBN 0-534-23832-7.
- ↑ Strecker, Adolph «Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper». Justus Liebigs Annalen der Chemie, 75, 1, 1850, pàg. 27–45. DOI: 10.1002/jlac.18500750103.
- ↑ Strecker, Adolph «Ueber einen neuen aus Aldehyd - Ammoniak und Blausäure entstehenden Körper». Justus Liebigs Annalen der Chemie, 91, 3, 1854, pàg. 349–51. DOI: 10.1002/jlac.18540910309.
- ↑ Masumoto S, Usuda H, Suzuki M, Kanai M, Shibasaki M «Catalytic enantioselective Strecker reaction of ketoimines». Journal of the American Chemical Society, 125, 19, maig 2003, pàg. 5634–5. DOI: 10.1021/ja034980. PMID: 12733893.
- ↑ Davis, F. A.; Reddy, Rajarathnam E.; Portonovo, Padma S. «Asymmetric strecker synthesis using enantiopure sulfinimines: A convenient synthesis of α-amino acids». Tetrahedron Letters, 35, 50, 1994, pàg. 9351. DOI: 10.1016/S0040-4039(00)78540-6.
- ↑ Ishitani, Haruro; Komiyama, Susumu; Hasegawa, Yoshiki [et al]. «Catalytic Asymmetric Strecker Synthesis. Preparation of Enantiomerically Pure α-Amino Acid Derivatives from Aldimines and Tributyltin Cyanide or Achiral Aldehydes, Amines, and Hydrogen Cyanide Using a Chiral Zirconium Catalyst». Journal of the American Chemical Society, 122, 5, 2000, pàg. 762–6. DOI: 10.1021/ja9935207.
- ↑ Huang, Jinkun; Corey, E. J. «A New Chiral Catalyst for the Enantioselective Strecker Synthesis of α-Amino Acids». Orgic Letters, 62, 6, 2004, pàg. 5027–9. DOI: 10.1021/ol047698w. PMID: 15606127.
- ↑ Duthaler, Rudolf O. «Recent developments in the stereoselective synthesis of α-aminoacids». Tetrahedron, 50, 6, 1994, pàg. 1539–1650. DOI: 10.1016/S0040-4020(01)80840-1.
- ↑ Jones, Russell Celyn; Buchanan, Bob B.; Gruissem, Wilhelm. Biochemistry & molecular biology of plants. Rockville, Md: American Society of Plant Physiologists, 2000, p. 371–2. ISBN 0-943088-39-9.
- ↑ Kivirikko KI, Pihlajaniemi T «Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases». Advances in Enzymology and Related Areas of Molecular Biology, 72, 1998, pàg. 325–98. PMID: 9559057.
- ↑ Whitmore L, Wallace BA «Analysis of peptaibol sequence composition: implications for in vivo synthesis and channel formation». European Biophysics Journal, 33, 3, maig 2004, pàg. 233–7. DOI: 10.1007/s00249-003-0348-1. PMID: 14534753.
- ↑ Alexander L, Grierson D «Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening». Journal of Experimental Botany, 53, 377, octubre 2002, pàg. 2039–55. DOI: 10.1093/jxb/erf072. PMID: 12324528.
- ↑ Ibba M, Söll D «The renaissance of aminoacyl-tRNA synthesis». EMBO Reports, 2, 5, maig 2001, pàg. 382–7. PMC: 1083889. PMID: 11375928.
- ↑ Lengyel P, Söll D «Mechanism of protein biosynthesis». Bacteriological Reviews, 33, 2, juny 1969, pàg. 264–301. PMC: 378322. PMID: 4896351.
- ↑ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND «Glutathione metabolism and its implications for health». The Journal of Nutrition, 134, 3, març 2004, pàg. 489–92. PMID: 14988435.
- ↑ Meister A «Glutathione metabolism and its selective modification». The Journal of Biological Chemistry, 263, 33, novembre 1988, pàg. 17205–8. Arxivat de l'original el 2020-06-10. PMID: 3053703 [Consulta: 17 novembre 2011]. Arxivat 2020-06-10 a Wayback Machine.
- ↑ Carpino, Louis A. «1-Hydroxy-7-azabenzotriazole. An efficient peptide coupling additive». Journal of the American Chemical Society, 115, 10, 1992, pàg. 4397–8. DOI: 10.1021/ja00063a082.
- ↑ Marasco D, Perretta G, Sabatella M, Ruvo M «Past and future perspectives of synthetic peptide libraries». Current Protein & Peptide Science, 9, 5, octubre 2008, pàg. 447–67. DOI: 10.2174/138920308785915209. PMID: 18855697.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L.. Biochemistry. San Francisco: W.H. Freeman, 2002, p. 639–49. ISBN 0-7167-4684-0.
- ↑ 80,0 80,1 Leuchtenberger W, Huthmacher K, Drauz K «Biotechnological production of amino acids and derivatives: current status and prospects». Applied Microbiology and Biotechnology, 69, 1, novembre 2005, pàg. 1–8. DOI: 10.1007/s00253-005-0155-y. PMID: 16195792.
- ↑ Ashmead, H. DeWayne. The Role of Amino Acid Chelates in Animal Nutrition. Westwood: Noyes Publications, 1993.
- ↑ Garattini S «Glutamic acid, twenty years later». The Journal of Nutrition, 130, 4S Suppl, abril 2000, pàg. 901S–9S. PMID: 10736350.
- ↑ Stegink LD «The aspartame story: a model for the clinical testing of a food additive». The American Journal of Clinical Nutrition, 46, 1 Suppl, juliol 1987, pàg. 204–15. PMID: 3300262.
- ↑ Albion Laboratories, Inc.. «Albion Ferrochel Website». Arxivat de l'original el de setembre 3, 2011. [Consulta: Cited: juliol 12, 2011].
- ↑ Ashmead, H. DeWayne. Foliar Feeding of Plants with Amino Acid Chelates. Park Ridge: Noyes Publications, 1986.
- ↑ Turner EH, Loftis JM, Blackwell AD «Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan». Pharmacology & Therapeutics, 109, 3, març 2006, pàg. 325–38. DOI: 10.1016/j.pharmthera.2005.06.004. PMID: 16023217.
- ↑ Kostrzewa RM, Nowak P, Kostrzewa JP, Kostrzewa RA, Brus R «Peculiarities of L: -DOPA treatment of Parkinson's disease». Amino Acids, 28, 2, març 2005, pàg. 157–64. DOI: 10.1007/s00726-005-0162-4. PMID: 15750845.
- ↑ Heby O, Persson L, Rentala M «Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas' disease, and leishmaniasis». Amino Acids, 33, 2, agost 2007, pàg. 359–66. DOI: 10.1007/s00726-007-0537-9. PMID: 17610127.
- ↑ Xie J, Schultz PG «Adding amino acids to the genetic repertoire». Curr Opin Chem Biol, 9, 6, desembre 2005, pàg. 548–54. DOI: 10.1016/j.cbpa.2005.10.011. PMID: 16260173.
- ↑ Wang Q, Parrish AR, Wang L «Expanding the genetic code for biological studies». Chem. Biol., 16, 3, març 2009, pàg. 323–36. DOI: 10.1016/j.chembiol.2009.03.001. PMC: 2696486. PMID: 19318213.
- ↑ Hanessian, S. «Reflections on the total synthesis of natural products: Art, craft, logic, and the chiron approach». Pure and Applied Chemistry, 65, 6, 1993, pàg. 1189–204. DOI: 10.1351/pac199365061189.
- ↑ Blaser, Hans Ulrich «The chiral pool as a source of enantioselective catalysts and auxiliaries». Chemical Reviews, 92, 5, 1992, pàg. 935–52. DOI: 10.1021/cr00013a009.
- ↑ Sanda, Fumio; Endo, Takeshi «Feature Article Syntheses and functions of polymers based on amino acids». Macromolecular Chemistry and Physics, 200, 12, 1999, pàg. 2651–61. DOI: 10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P.
- ↑ Gross, R. A.; Kalra, B. «Biodegradable Polymers for the Environment». Science, 297, 5582, 2002, pàg. 803–807. Bibcode: 2002Sci...297..803G. DOI: 10.1126/science.297.5582.803. PMID: 12161646.
- ↑ Low, K. C.; Wheeler, A. P.; Koskan, L. P.. Commercial poly(aspartic acid) and Its Uses. 248. Washington, D.C.: Societat Química Americana, 1996 (Advances in Chemistry Series).
- ↑ Thombre, S.M.; Sarwade, B.D. «Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review». Journal of Macromolecular Science, Part A, 42, 9, 2005, pàg. 1299–1315. DOI: 10.1080/10601320500189604.
- ↑ Bourke, S. L.; Kohn, J. «Polymers derived from the amino acid l-tyrosine: polycarbonates, polyarylates and copolymers with poly(ethylene glycol)». Advanced Drug Delivery Reviews, 55, 4, 2003, pàg. 447–466. DOI: 10.1016/S0169-409X(03)00038-3. PMID: 12706045.
