Absorció (química): diferència entre les revisions
m r2.7.1) (Robot afegeix: fa:جذب (شیمی) |
m Robot afegeix: hu:Abszorpció (kémia) |
||
| Línia 38: | Línia 38: | ||
[[fr:Absorption (physique)]] |
[[fr:Absorption (physique)]] |
||
[[hi:अवशोषक]] |
[[hi:अवशोषक]] |
||
[[hu:Abszorpció (kémia)]] |
|||
[[id:Absorpsi]] |
[[id:Absorpsi]] |
||
[[it:Absorbimento]] |
[[it:Absorbimento]] |
||
Revisió del 09:38, 12 feb 2013
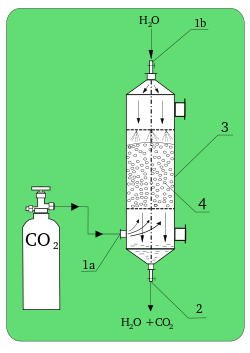
Absorció química és la incorporació d'una substància en un estat en una altra en un estat diferent.
És l'operació unitària que consisteix en la separació d'un o més components d'una mescla gasosa amb l'ajut d'un solvent líquid amb el qual forma dissolució (un solut A, o diversos soluts, s'absorbeixen de la fase gasosa i passen a la líquida). Aquest procés implica una difusió molecular turbulenta o una transferència de massa del solut A a través del gas B, que no es difon i està en repòs, cap un líquid C, també en repòs. Un exemple és l'absorció d'amoníac A de l'aire B mitjançant aigua líquida C. El procés invers de l'absorció s'anomena empobriment o desabsorció; quan el gas és aire pur i el líquid es aigua pura, el procés s'anomena deshumidificació, la deshumidificació significa extracció de vapor d'aigua de l'aire.
Regla de les fases i equilibri
Per a predir la concentració d'un solut en dues fases en equilibri, es requereixen dades d'equilibri experimentals. A més, si les dues fases no estan en equilibri, la velocitat de transferència de massa és proporcional a la força impulsora, que és la desviació ambrespecte l'equilibri. Les variables importants que afecten l'equilibri d'un solut són temperatura, presió i concentració. L'equilibri entre dues fases en qualsevol cas, està restringit per la regla de les fases: on P es el nombre de fases en equilibri, C es el nombre de components totals en les dues fases (quan no es verifiquen reaccions químiques), i F es el nombre de variants o graus de llibertat del sistema. Per a l'equilibri líquid-gas es tenen dos components i dues fases i per tant: Es tenen 2 graus de llibertat i les combinacions poden ser: (PA, T),(yA, T),(xA, T),…
Elecció del disolvent per a l'absorció
Si el propòsit principal de l'operació d'absorció es produir una solució específica, el disolvent és especificat per la naturalesa del producte. Si el propòsit principal és eliminar algun component del gas, gairebé sempre existeix la possibilitat d'elecció. S'ha de donar importància a les següents propietats:
1.Solubilitat del gas que ha de ser alta per tal d'augmentar la rapidesa de l'absorció. 2.Volatilitat,el disolvent ha de tenir una pressió baixa de vapor. 3.Corrosió. 4.Cost baix. 5.Viscositat, és millor que sigui baixa. 6.Altres: el disolvent és preferible que no sigui tòxic, ni inflamable, estable químicamenti de punt baix de congelació.


