Molècula amfipàtica: diferència entre les revisions
Robot posa data a plantilles de manteniment |
ortografia |
||
| Línia 1: | Línia 1: | ||
{{ortografia|data=desembre de 2014}} |
{{ortografia|data=desembre de 2014}} |
||
[[Fitxer:Phospholipid.svg|thumb|240px|Els [[fosfolípids]] tenen un comportament amfipàtic.]] |
[[Fitxer:Phospholipid.svg|thumb|240px|Els [[fosfolípids]] tenen un comportament amfipàtic.]] |
||
Una '''molècula amfipàtica '''o''' anfifílica''' és aquella [[molècula]] que en la seva [[estructura molecular]] tenen un extrem [[hidrofília (química)|hidrofílic]] o sigui que és soluble en aigua i un altre [[hidròfob]] és a dir que rebutja l'aigua. Així, per exemple, qualsevol tipus |
Una '''molècula amfipàtica '''o''' anfifílica''' és aquella [[molècula]] que en la seva [[estructura molecular]] tenen un extrem [[hidrofília (química)|hidrofílic]], o sigui, que és soluble en aigua i un altre d'[[hidròfob]], és a dir, que rebutja l'aigua. Així, per exemple, qualsevol tipus d'[[oli]] és hidròfob perquè no pot incorporar l'aigua. Comunament aquestes dues parts tendirien a separar si s'agreguen a una barreja de dues substàncies, una d'hidrofòbica i una d'hidrofílica, fet que no pot es complir perquè es troben unides per un [[enllaç químic]]. |
||
Aquests compostos que contenen grups simultanis fortament no polars i grups fortament polars, l'aigua els dispersa o els solubilitza formant [[micel·les]] sobre bicapes. Un exemple senzill de biomolècula anfifílica que tendeix a formar micel·les és la sal sòdica de l'[[àcid oleic]]; aquesta molècula té un sol grup carboxil que és polar i tendeix per això a hidratar amb facilitat, i una llarga cua hidrocarbonada, que és no polar i intrínsecament insoluble en l'aigua. |
|||
Un altre exemple són els fosfolípids, compostos per dos àcids grassos, els extrems hidròfobs, i un àcid fosfòric i un aminoalcohol (l'extrem hidròfil). Aquest també és el cas dels sabons, ja que les molècules de sabó s'adhereixen per una banda a les molècules d'aigua i per l' |
Un altre exemple són els fosfolípids, compostos per dos àcids grassos, els extrems hidròfobs, i un àcid fosfòric i un aminoalcohol (l'extrem hidròfil). Aquest també és el cas dels sabons, ja que les molècules de sabó s'adhereixen per una banda a les molècules d'aigua i per l'altra a les partícules de brutícia. |
||
Els [[triglicèrids]] no són anfipàtics, no són solubles en aigua |
Els [[triglicèrids]] no són anfipàtics, no són solubles en aigua, és a dir, no compleixen amb la doble característica de ser solubles en solvents orgànics (no polars) i en l'aigua (polar). No és amfipàtic, ja que les parts polars de la [[glicerina]] i dels àcids grassos formen part dels enllaços èster. El triglicèrid, a diferència del [[fosfolípid]], no té el grup fosfat que és precisament el que li confereix aquesta característica amfipàtica. |
||
== Estructura hidrofòbica (o no polar) == |
== Estructura hidrofòbica (o no polar) == |
||
| Línia 13: | Línia 13: | ||
== Estructura hidrofílica (o polar) == |
== Estructura hidrofílica (o polar) == |
||
Quan hi ha un enllaç entre dos tipus d'àtoms diferents es té una molècula polar. Aquest enllaç es presenta pel fet que els dos àtoms tenen diferents electronegativitats. |
Quan hi ha un enllaç entre dos tipus d'àtoms diferents es té una molècula polar. Aquest enllaç es presenta pel fet que els dos àtoms tenen diferents electronegativitats. El terme polar indica una distribució desigual de càrrega elèctrica. |
||
== Interaccions hidrofòbiques == |
== Interaccions hidrofòbiques == |
||
Es denominen interaccions hidrofòbiques |
Es denominen interaccions hidrofòbiques aquelles forces que mantenen juntes les regions apolars de les molècules, i es refereixen a l'associació de les porcions hidrofòbiques de les molècules anfifíliques. En comparació amb els enllaços d'hidrogen, les interaccions hidrofòbiques tenen poc caràcter direccional, però tendeixen a produir sistemes d'elevada estabilitat. La força d'aquestes interaccions no es deu a cap atracció intrínseca entre les parts apolars. Rep també el nom d'efecte hidrofòbic, i aquest es resumeix com el conjunt de factors termodinàmics que són responsables de l'agrupament de les parts no polars d'un medi aquós. |
||
== Micel·les == |
== Micel·les == |
||
{{AP|micel·la}} |
{{AP|micel·la}} |
||
Quan s'agita una barreja d'aigua i àcid oleic en la seva forma -COOH, el resultat és una suspensió blanca i tèrbola que dura pocs minuts abans de tornar a separar-se en les dues fases |
Quan s'agita una barreja d'aigua i àcid oleic en la seva forma -COOH, el resultat és una suspensió blanca i tèrbola que dura pocs minuts abans de tornar a separar-se en les dues fases origiinals. Aquesta suspensió consta de partícules esfèriques, anomenades micel·les, les quals es formen per efectes hidrofòbics. Quan les molècules d'[[àcid oleic]] es barregen inicialment amb l'[[aigua]], algunes de les molècules d'aquesta última s'orienten al voltant de cada molècula d'àcid oleic, i entaulen amb ella interaccions de tipus dipol. En aquesta estructura la part no polar forma la part central, i cap a l'exterior se situa la part polar que per les seves característiques pot interaccionar amb l'aigua. |
||
[[Fitxer: Micelle.png|230px|dreta|Estructura d'una micela]] |
[[Fitxer: Micelle.png|230px|dreta|Estructura d'una micela]] |
||
== Aplicacions == |
== Aplicacions == |
||
La tecnologia anomenada |
La tecnologia anomenada sonolisi administra en el torrent sanguini microbombolles encapsulades en micel·les grasses. Aquesta tecnologia, juntament amb els ultrasons, és un avenç per a la prevenció d'infarts. |
||
== Tensoactius == |
== Tensoactius == |
||
{{AP|tensioactiu}} |
{{AP|tensioactiu}} |
||
Una de les manifestacions dels tensioactius és la propietat de formar micel·les. La naturalesa d'aquestes substàncies és |
Una de les manifestacions dels tensioactius és la propietat de formar micel·les. La naturalesa d'aquestes substàncies és anfifílica i, per tant, s'absorbeixen en interfícies. En una interfase aire-aigua, la part hidrofòbica del tensioactiu és dirigida cap amunt en l'aire i la part hidrofílica s'associa amb la fase d'aigua. La part hidrofílica del tensioactiu tendeix a quedar-se a la superfície perquè l'altra part tendeix a estar en contacte amb l'aire, i aquest fet fa que les molècules de l'aigua a la superfície es desplacin a sota de la superfície i que la tensió superficial de l'aigua disminueixi. Els sabons són, en general, sals orgàniques que contenen una part polar capaç d'interaccionar i dissoldre's a l'aigua, i per això es diu que és una part hidròfila, i l'altra apolar, que és hidròfoba o lipofílic (és a dir, amb tendència a interaccionar amb els greixos i altres compostos orgànics apolars). |
||
Malauradament els tensioactius dels detergents són uns dels majors contaminants de les aigües residuals; per contrarestar aquest dany ambiental, l'Institut Investigacions Químiques i Ambientals del CSIC a Barcelona i dirigit per Damià Barceló, treballa en la construcció d'un sensor anomenat ELISA, que amb l'ús d'[[anticossos]] revela quina quantitat de tensioactiu hi ha a l'[[aigua]], i també ajuda a determinar els [[metabòlit]]s dels "linear alquilbenzenosulfonatos" que són els tensioactius més utilitzats en els detergents d'ús domèstic.<ref> |
|||
{{ref-web|url=http://www.solociencia.com/ingenieria/06101806.htm|títol=Sensor para los tensioactivos <!--Títol generat per bot-->}} Solociencia.com </ref> |
{{ref-web|url=http://www.solociencia.com/ingenieria/06101806.htm|títol=Sensor para los tensioactivos <!--Títol generat per bot-->}} Solociencia.com </ref> |
||
== Liposomes == |
== Liposomes == |
||
{{AP|Liposoma}} |
{{AP|Liposoma}} |
||
Hi ha diversos tipus de materials lipídics amfipàtics que poden barrejar amb aigua en condicions específiques per formar liposomes |
Hi ha diversos tipus de materials lipídics amfipàtics que poden barrejar-se amb aigua en condicions específiques per formar liposomes. A diferència de l'agrupament de les estructures apolars al centre de la micel, molt compacte, en un liposoma els lípids apolars s'agrupen a banda i banda, i formen dues capes, de manera que integren [[esfera|esfere]]<nowiki/>s bicapa concèntriques que envolten completament una regió interna d'aigua. |
||
== Investigacions en curs == |
== Investigacions en curs == |
||
Gràcies a |
Gràcies a la investigació s'estan creant molècules capaces d'incorporar a l'interior de la seva estructura fàrmacs encapsulats, com ho són els [[polímers]] cristall-líquid colestèrics. Aquests polímers són capaços de transportar i atrapar molècules més petites gràcies a les seves molècules anfifíliques que s'autoassocien. Actualment el seu estudi es basa en el transport de fàrmacs específics i biomacromolècules.<ref> |
||
{{ref-web|url=http://www.serina.es/escaparate/verproducto.cgi?idproducto=2656&refcompra=NULO|títol=Polímeros quirales para el transporte y liberación controlada de principios activos | arxiuurl=http://web.archive.org/web/20070104230414/http://www.serina.es/escaparate/verproducto.cgi?idproducto=2656&refcompra=NULO | arxiudata=4 de gener de 2007}}</ref> |
{{ref-web|url=http://www.serina.es/escaparate/verproducto.cgi?idproducto=2656&refcompra=NULO|títol=Polímeros quirales para el transporte y liberación controlada de principios activos | arxiuurl=http://web.archive.org/web/20070104230414/http://www.serina.es/escaparate/verproducto.cgi?idproducto=2656&refcompra=NULO | arxiudata=4 de gener de 2007}}</ref> |
||
== Producció d'òxids metàl·lics == |
== Producció d'òxids metàl·lics == |
||
Els tensioactius s'utilitzen actualment en l'obtenció d'òxids metàl·lics mesoporosos |
Els tensioactius s'utilitzen actualment en l'obtenció d'òxids metàl·lics mesoporosos; els tensioactius agregats a la solució normal de sol-gel, en l'obtenció d'aquests òxids, formen esferes i estructures hexagonals semblants a les [[bresca |bresques]] d'abella, que en afegir alcòxid formen un gel, de manera que el tensioactiu desapareix deixant un porus. |
||
Aquest |
Aquest avenç es va aconseguir gràcies a les investigacions de la Universitat Autònoma Metropolitana.<ref> [http://www.invdes.siw.com.mx/activacioncathistorial.asp?YearID=9&Year=2006&MesID=2&Mes=Febrero&SubCategoriaID=1364&CategoriaID=1 Ciència i Tecnologia -:: Investigació i Desenvolupament:: Periodisme en Salut, Ciència i Tecnologia:: Mèxic <!-- Títol generat per un bot --->]</ref> |
||
== Notes == |
== Notes == |
||
Revisió del 16:58, 14 gen 2015
|
|
L'article necessita algunes millores pel que fa a l'ortografia i la gramàtica. |
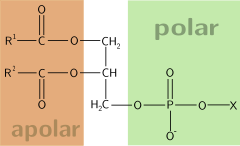
Una molècula amfipàtica o anfifílica és aquella molècula que en la seva estructura molecular tenen un extrem hidrofílic, o sigui, que és soluble en aigua i un altre d'hidròfob, és a dir, que rebutja l'aigua. Així, per exemple, qualsevol tipus d'oli és hidròfob perquè no pot incorporar l'aigua. Comunament aquestes dues parts tendirien a separar si s'agreguen a una barreja de dues substàncies, una d'hidrofòbica i una d'hidrofílica, fet que no pot es complir perquè es troben unides per un enllaç químic.
Aquests compostos que contenen grups simultanis fortament no polars i grups fortament polars, l'aigua els dispersa o els solubilitza formant micel·les sobre bicapes. Un exemple senzill de biomolècula anfifílica que tendeix a formar micel·les és la sal sòdica de l'àcid oleic; aquesta molècula té un sol grup carboxil que és polar i tendeix per això a hidratar amb facilitat, i una llarga cua hidrocarbonada, que és no polar i intrínsecament insoluble en l'aigua.
Un altre exemple són els fosfolípids, compostos per dos àcids grassos, els extrems hidròfobs, i un àcid fosfòric i un aminoalcohol (l'extrem hidròfil). Aquest també és el cas dels sabons, ja que les molècules de sabó s'adhereixen per una banda a les molècules d'aigua i per l'altra a les partícules de brutícia.
Els triglicèrids no són anfipàtics, no són solubles en aigua, és a dir, no compleixen amb la doble característica de ser solubles en solvents orgànics (no polars) i en l'aigua (polar). No és amfipàtic, ja que les parts polars de la glicerina i dels àcids grassos formen part dels enllaços èster. El triglicèrid, a diferència del fosfolípid, no té el grup fosfat que és precisament el que li confereix aquesta característica amfipàtica.
Estructura hidrofòbica (o no polar)
En una molècula no polar els electrons compartits estan igualment atrets pels dos àtoms. Aquests enllaços es formen entre àtoms amb valors d'electronegativitat similars.
Estructura hidrofílica (o polar)
Quan hi ha un enllaç entre dos tipus d'àtoms diferents es té una molècula polar. Aquest enllaç es presenta pel fet que els dos àtoms tenen diferents electronegativitats. El terme polar indica una distribució desigual de càrrega elèctrica.
Interaccions hidrofòbiques
Es denominen interaccions hidrofòbiques aquelles forces que mantenen juntes les regions apolars de les molècules, i es refereixen a l'associació de les porcions hidrofòbiques de les molècules anfifíliques. En comparació amb els enllaços d'hidrogen, les interaccions hidrofòbiques tenen poc caràcter direccional, però tendeixen a produir sistemes d'elevada estabilitat. La força d'aquestes interaccions no es deu a cap atracció intrínseca entre les parts apolars. Rep també el nom d'efecte hidrofòbic, i aquest es resumeix com el conjunt de factors termodinàmics que són responsables de l'agrupament de les parts no polars d'un medi aquós.
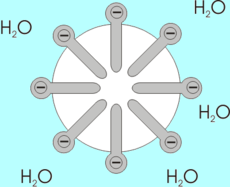
Micel·les
Quan s'agita una barreja d'aigua i àcid oleic en la seva forma -COOH, el resultat és una suspensió blanca i tèrbola que dura pocs minuts abans de tornar a separar-se en les dues fases origiinals. Aquesta suspensió consta de partícules esfèriques, anomenades micel·les, les quals es formen per efectes hidrofòbics. Quan les molècules d'àcid oleic es barregen inicialment amb l'aigua, algunes de les molècules d'aquesta última s'orienten al voltant de cada molècula d'àcid oleic, i entaulen amb ella interaccions de tipus dipol. En aquesta estructura la part no polar forma la part central, i cap a l'exterior se situa la part polar que per les seves característiques pot interaccionar amb l'aigua.
Aplicacions
La tecnologia anomenada sonolisi administra en el torrent sanguini microbombolles encapsulades en micel·les grasses. Aquesta tecnologia, juntament amb els ultrasons, és un avenç per a la prevenció d'infarts.
Tensoactius
Una de les manifestacions dels tensioactius és la propietat de formar micel·les. La naturalesa d'aquestes substàncies és anfifílica i, per tant, s'absorbeixen en interfícies. En una interfase aire-aigua, la part hidrofòbica del tensioactiu és dirigida cap amunt en l'aire i la part hidrofílica s'associa amb la fase d'aigua. La part hidrofílica del tensioactiu tendeix a quedar-se a la superfície perquè l'altra part tendeix a estar en contacte amb l'aire, i aquest fet fa que les molècules de l'aigua a la superfície es desplacin a sota de la superfície i que la tensió superficial de l'aigua disminueixi. Els sabons són, en general, sals orgàniques que contenen una part polar capaç d'interaccionar i dissoldre's a l'aigua, i per això es diu que és una part hidròfila, i l'altra apolar, que és hidròfoba o lipofílic (és a dir, amb tendència a interaccionar amb els greixos i altres compostos orgànics apolars).
Malauradament els tensioactius dels detergents són uns dels majors contaminants de les aigües residuals; per contrarestar aquest dany ambiental, l'Institut Investigacions Químiques i Ambientals del CSIC a Barcelona i dirigit per Damià Barceló, treballa en la construcció d'un sensor anomenat ELISA, que amb l'ús d'anticossos revela quina quantitat de tensioactiu hi ha a l'aigua, i també ajuda a determinar els metabòlits dels "linear alquilbenzenosulfonatos" que són els tensioactius més utilitzats en els detergents d'ús domèstic.[1]
Liposomes
Hi ha diversos tipus de materials lipídics amfipàtics que poden barrejar-se amb aigua en condicions específiques per formar liposomes. A diferència de l'agrupament de les estructures apolars al centre de la micel, molt compacte, en un liposoma els lípids apolars s'agrupen a banda i banda, i formen dues capes, de manera que integren esferes bicapa concèntriques que envolten completament una regió interna d'aigua.
Investigacions en curs
Gràcies a la investigació s'estan creant molècules capaces d'incorporar a l'interior de la seva estructura fàrmacs encapsulats, com ho són els polímers cristall-líquid colestèrics. Aquests polímers són capaços de transportar i atrapar molècules més petites gràcies a les seves molècules anfifíliques que s'autoassocien. Actualment el seu estudi es basa en el transport de fàrmacs específics i biomacromolècules.[2]
Producció d'òxids metàl·lics
Els tensioactius s'utilitzen actualment en l'obtenció d'òxids metàl·lics mesoporosos; els tensioactius agregats a la solució normal de sol-gel, en l'obtenció d'aquests òxids, formen esferes i estructures hexagonals semblants a les bresques d'abella, que en afegir alcòxid formen un gel, de manera que el tensioactiu desapareix deixant un porus.
Aquest avenç es va aconseguir gràcies a les investigacions de la Universitat Autònoma Metropolitana.[3]
Notes
- ↑ «Sensor para los tensioactivos». Solociencia.com
- ↑ «Polímeros quirales para el transporte y liberación controlada de principios activos». Arxivat de l'original el 4 de gener de 2007.
- ↑ Ciència i Tecnologia -:: Investigació i Desenvolupament:: Periodisme en Salut, Ciència i Tecnologia:: Mèxic
Bibliografia
- NELSON, Philip. "Física Biològica: energia, informació i vida". Editorial Reverté. 2005. Pàg: 317-364.
- BOHINSKI, Robert C. "Bioquímica". Editorial Adisson Wesley. Cinquena edició. Pàg: 40-46
- NELSON, David L. COX, Michael. "Principis de Bioquímica" Edicions Omega. Tercera edició. Pàg: 86 - 90, 392-395.
- TORRES, Hector N. "Bioquímica General". Editorial L'Ateneu. Pàg: 85 - 90.
