Escumant: diferència entre les revisions
m Corregit: entre sí: * [[Detergència > entre si: * [[Detergència |
m Corregit: el propi [[àcid > el mateix [[àcid |
||
| Línia 30: | Línia 30: | ||
[[Fitxer:Micelle scheme-en.svg|thumb|250px|right|Estructura d'una [[micel·la]]. Els caps polars estan en contacte amb l'aigua i les cues apolars repel·len l'aigua]]Els agents escumants estan molt presents, com ja hem dit anteriorment, en [[cosmètica]]. Els trobem, principalment, en '''sabons'''. |
[[Fitxer:Micelle scheme-en.svg|thumb|250px|right|Estructura d'una [[micel·la]]. Els caps polars estan en contacte amb l'aigua i les cues apolars repel·len l'aigua]]Els agents escumants estan molt presents, com ja hem dit anteriorment, en [[cosmètica]]. Els trobem, principalment, en '''sabons'''. |
||
De forma general, la sal d'un [[àcid carboxílic]] és més soluble en aigua que el |
De forma general, la sal d'un [[àcid carboxílic]] és més soluble en aigua que el mateix [[àcid]]. Quan la part hidrocarbonada de l'àcid és molt gran en comparació amb el grup carboxilat, la part iònica de la molècula interacciona favorablement amb l'[[aigua]] i tendeix a dissoldre's, però la resta de la cadena no. Per [[forces de Van der Waals]], les cadenes hidrocaronades de molècules veïnes s'atrauen mútuament més del que ho estan per les molècules polars de l'aigua. Com ja s'ha comentat abans, l'estructura d'aquests compostos provoca una orientació particular de les seves molècules a la superfície de l'aigua: els caps polars estan encarats a l'aigua, mentre que les cues apolars sobresurten a l'[[aire]], evitant el contacte amb l'aigua. Les molècules que es troben a la superfície de l'aigua no presenten forces d'atracció cap a totes les direccions, només se senten atretes per les molècules de l'interior. La concentració de molècules en la superfície de l'aigua provoca que la seva [[tensió superficial]] disminueixi. Els compostos que presenten aquest comportament, són els tensioactius. Doncs bé, els sabons són un tipus de compost tensioactiu. Quan s'assoleix una concentració crítica de surfactant, la capa superficial es trenca en unitats més petites, en agrupacions d'ions anomenades [[micel·les]]. És, doncs, quan a causa d'una elevada concentració de tensioactiu, la tensió superficial disminueix. |
||
Revisió del 14:18, 26 feb 2016

Un escumant és aquella substància que facilita la formació d'escumes. Es tracta d'un agent tensioactiu.
Un agent tensioactiu (surfactant) és una substància que té la propietat d'alterar l'energia d'una superfície amb la qual entra en contacte, mitjançant porcessos d'adsorció. Aquesta disminució de la tensió superficial pot ser observada fàcilment en escumants. L'ús de tensioactius va molt lligat a la cosmètica, així com els detergents, humectants, escumants, emulsions i solubilitzacions. En el cas dels escumants, podem dir que alguns productes necessiten tenir una elevada proporció d'escuma per l'ús que se’ls dóna. Per aquests productes, s'utilitzaran agents tensioactius especials, per exemple, en xampús i escumes de bany.
Classificació dels tensioactius
Els agents tensioactius comparteixen una característica estructural: són molècules amfòteres, és a dir, que consten de dues unitats, una hidròfoba (no soluble en aigua) i l'altra hidròfila (soluble en aigua). Generalment, les unitats hidròfobes són cadenes o anells d'hidrocarburs o una mescla d'ambdós. Usualment, les unitats hidròfiles són grups polars tals com grup carboxil, sulfat o sulfonat o, en tensioactius no iònics, diferents grups hidroxil o èter. Aquesta propietat ens permet entendre la seva disposició en dissolucions aquoses. Segons el comportament iònic en solució aquosa, els tensioactius es poden classificar en quatre grups:
- Catiònics: l'ió tensioactiu està carregat positivament en solució aquosa (p.e: sals de fosfoni)
- Aniònics: l'ió tensioactiu està carregat negativament en solució aquosa (p.e: oleat sòdic)
- Anfòters: formen un ió tensioactiu amb càrregues tant positives com negatives (p.e: acil pèptids)
- No iònics: la part hidròfila de la molècula generalment està constituïda per múltiples grups petits polars no carregats (p.e: alcanolamides d'àcids grassos)
Propietats dels agents tensioactius

Observem a la corba que a mesura que augmenta la concentració de tensioactiu en la solució, la tensió superficial baixarà molt ràpidament. Aquesta brusca baixada en la tensió superficial afectarà en la tensió interfacial, en la conductivitat elèctrica, etc. de la dissolució. Es pot observar, també, com a partir d'un cert punt, es presenta una discontinuïtat i la tensió superficial i altres propietats no cauen més. Aquesta discontinuïtat es produeix en el moment de la concentració micel·lar crítica (CMC).
Podríem dir, doncs, que en general, amb la caiguda de la tensió superficial també cauran la tensió interfacial, proporcionant millors propietats emulsionants i detergents; mentre que al mateix temps, s'incrementaran les propietats escumants i humectants. Per concloure, a concentracions superiors a la CMC, tots els agents tensioactius tenen certes propietats solubilitzants. Totes aquestes propietats, doncs, estan connectades entre si:
- Detergència
- Emulsificació
- Solubilització
- Escumant
- Altres propietats
Poder escumant en sabons
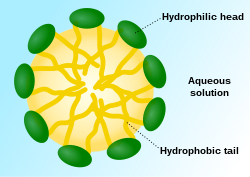
Els agents escumants estan molt presents, com ja hem dit anteriorment, en cosmètica. Els trobem, principalment, en sabons.
De forma general, la sal d'un àcid carboxílic és més soluble en aigua que el mateix àcid. Quan la part hidrocarbonada de l'àcid és molt gran en comparació amb el grup carboxilat, la part iònica de la molècula interacciona favorablement amb l'aigua i tendeix a dissoldre's, però la resta de la cadena no. Per forces de Van der Waals, les cadenes hidrocaronades de molècules veïnes s'atrauen mútuament més del que ho estan per les molècules polars de l'aigua. Com ja s'ha comentat abans, l'estructura d'aquests compostos provoca una orientació particular de les seves molècules a la superfície de l'aigua: els caps polars estan encarats a l'aigua, mentre que les cues apolars sobresurten a l'aire, evitant el contacte amb l'aigua. Les molècules que es troben a la superfície de l'aigua no presenten forces d'atracció cap a totes les direccions, només se senten atretes per les molècules de l'interior. La concentració de molècules en la superfície de l'aigua provoca que la seva tensió superficial disminueixi. Els compostos que presenten aquest comportament, són els tensioactius. Doncs bé, els sabons són un tipus de compost tensioactiu. Quan s'assoleix una concentració crítica de surfactant, la capa superficial es trenca en unitats més petites, en agrupacions d'ions anomenades micel·les. És, doncs, quan a causa d'una elevada concentració de tensioactiu, la tensió superficial disminueix.

El poder netejant del sabó és fàcilment explicable. Els greixos tenen una composició química similar a les cadenes hidrocarbonades de la micel·la. Si es frega una taca de greix amb una solució de sabó, el que es provoca és un trencament del greix en partícules suficientment petites com per ser englobades dins les micel·les.
Químicament, el sabó és una mescla de les sals de sodi i potassi d’àcids grassos de cadena llarga produïts per hidròlisi (saponificació) de greix animal amb àlcali, és a dir, que s'obtenen quan els greixos o els olis s'hidrolitzen en condicions bàsiques.

Tres dels sabons més comuns són:
- Estearat de sodi
- Oleat de sodi
- Linoleat de sodi
Si bé és veritat que el poder escumant és important en l'aplicació en sabons, cal remarcar que l'escuma que apareix en el sabó no està relacionada amb el poder netejant d'aquest.
En funció del tipus de tensioactiu que contingui el detergent, el poder escumant serà menor o major, així, els tensioactius que proporcionen més escuma seran els que continguin tensioactius aniònics, mentre que els catiònics produeixen molt poca escuma.
Els escumants tenen la capacitat de suportar elevades temperatures, una alta concentració de sals i l'aigua dura. Els agents escumants per si mateixos ja contenen substàncies polimèriques i són normalment surfactants aniònics.
Problemes mediambientals a causa de l'excés d'escuma
L'agent escumant pot resultar perjudicial per al medi ambient si tenim en compte que els escumants envolten les partícules, dificultant-ne la seva dilució. Un cas és el de l'oxigen. Si els agents escumants dificulten la dilució de l'oxigen de l'atmosfera en l'aigua, la superfície de l'aigua en contacte amb l'aire serà abundant en greixos, tensioactius, etc.
Exemples d'escumants
| Nom comú | Fórmula química | Pes molecular (g/mol) |
| MICB | CH3CHCH2CH(OH)CH | 102.2 |
| HEX | C5H13OH | 102.2 |
| DF-200 | CH3(PO)3OH | 206.29 |
| DF-250 | CH3(PO)4OH | 264.37 |
Bibliografia
- EGE, Seyhan N.Química orgánica : estructura y reactividad. Barcelona. Editorial Reverté, 2000.
- McMURRY, John. Química orgánica. Madrid. International Thomson Editores, 20001.
- BRUICE, Paula Yurkanis. Química orgánica : quinta edición. México. Pearson Education, 2008.
- J. B. WILKINSON-R. J. MOORE. Cosmetología de Harry. Madrid. Ediciones DÍAZ DE SANTOS, 2001.
