Òxids de sofre: diferència entre les revisions
m bot: - sal intermedia del + sal intermèdia del |
AAA x ccc Etiquetes: repetició de caràcters editor visual |
||
| Línia 1: | Línia 1: | ||
Els òxids de sofre poden ser de tres tipus: |
Els òxids de sofre poden ser de tres tipus:COINTREAU |
||
A |
|||
A |
|||
A |
|||
A |
|||
A |
|||
A |
|||
A |
|||
A |
|||
AA |
|||
A |
|||
A |
|||
A |
|||
A |
|||
A |
|||
*Òxid de sofre (II) o monòxid de sofre, amb la fórmula SO |
|||
*Òxid de sofre (IV) o diòxid de sofre, amb la fórmula SO<sub>2</sub> |
|||
*Òxid de sofre (VI) o triòxid de sofre, amb la fórmula SO<sub>3</sub> |
|||
==Monòxid de sofre== |
|||
[[Fitxer:Sulfur-monoxide-2D.svg|thumb|150px|[[Estructura de Lewis]] del monòxid de sofre.]] |
[[Fitxer:Sulfur-monoxide-2D.svg|thumb|150px|[[Estructura de Lewis]] del monòxid de sofre.]] |
||
Es tracta d'una [[espècie]] inestable que es forma quan l'[[oxigen]] [[monoatòmic]] reacciona amb el [[sofre]]: |
Es tracta d'una [[espècie]] inestable que es forma quan l'[[oxigen]] [[monoatòmic]] reacciona amb el [[sofre]]: |
||
Revisió del 18:25, 19 març 2019
Els òxids de sofre poden ser de tres tipus:COINTREAU
A
A
A
A
A
A
A
A
AA
A
A
A
A
A
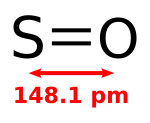
Es tracta d'una espècie inestable que es forma quan l'oxigen monoatòmic reacciona amb el sofre:
- 2S + O2 → 2SO
En afegir aigua a l'òxid de sofre (II) es produeix àcid hiposulfurós:
- SO + H2O → H2SO2
Diòxid de sofre
El diòxid de sofre es forma en el procés de combustió del sofre[1] i del sulfur d'hidrògen.
- S8 + 8 O2 → 8 SO2
- 2 H2S + 3 O2 → 2 H2O + 2 SO2
Triòxid de sofre
L'òxid de sofre (IV) pot ser preparat al laboratori mitjançant piròlisi en dues etapes a partir d'hidrogensulfat de sodi
- 1) Deshidratació
- 2NaHSO4 → Na2S2O7 + H2O a 315°C
- 2) Cracking
- Na2S2O7 → Na2SO4 + SO3 a 460°C
Aquest mètode funciona per altres hidrogensulfats metàl·lics, sent el factor controlant l'estabilitat de la sal intermèdia del pirosulfat.
Òxids de sofre i piròlisi
Molts residus contenen sofre que pot presentar-se en tots els estats d’oxidació des de S-2 fins S+6. En qualsevol cas, el sofre apareix en els gasos com a SO2 o SO3. Donada l'atmosfera inert en què es desenvolupa la piròlisi, els nivells d’òxid de sofre produïts per aquesta via són més baixos que els superats per incineració. Depenent de la composició de les cendres, una porció dels òxids de sofre dels gasos pot patir una reacció gas-sòlid, quedant-se així atrapats en la cendra.
La proporció entre SO2 i SO3 depèn de la temperatura, composició dels gasos i presència o absència de material catalític en les cendres. En la incineració, un excés d’oxigen afavoreix l’oxidació a SO3, però, en tractar-se d’una reacció lenta, generalment només un 2-4% del sofre apareix com a triòxid.
Els òxids de sofre tenen importància com a contaminants degut als seus efectes perjudicials sobre la salut i els seus efectes corrosius sobre els materials.
Referències
- ↑ López Arriaga, Jerónimo Amado. «Contaminación atmosférica». A: Principios básicos de contaminación ambiental. Universidad Autónoma de México, 2003, p. 191-216. ISBN 9688358134.
