Sòlid amorf: diferència entre les revisions
m Aplicant la plantilla {{PMID}} per evitar l'enllaç màgic de PMID |
m |200px|thumb -> |miniatura |
||
| Línia 1: | Línia 1: | ||
{{FR|data=2014}} |
{{FR|data=2014}} |
||
[[Fitxer:SiO² Quartz.svg| |
[[Fitxer:SiO² Quartz.svg|miniatura|Diagrama molecular del quars (SiO<sub>2</sub>) en xarxa cristallina.]] |
||
El '''sòlid amorf''' és un [[estat sòlid]] de la matèria, en el qual les partícules que conformen el sòlid no tenen una estructura ordenada. Aquests tipus de sòlids no tenen formes i cares ben definides. Aquesta classificació contrasta amb la dels [[cristall|sòlids cristallins]], els [[àtoms]] dels quals estan disposats de manera regular i ordenada formant [[xarxa cristal·lina|xarxes cristal·lines]]. |
El '''sòlid amorf''' és un [[estat sòlid]] de la matèria, en el qual les partícules que conformen el sòlid no tenen una estructura ordenada. Aquests tipus de sòlids no tenen formes i cares ben definides. Aquesta classificació contrasta amb la dels [[cristall|sòlids cristallins]], els [[àtoms]] dels quals estan disposats de manera regular i ordenada formant [[xarxa cristal·lina|xarxes cristal·lines]]. |
||
[[Fitxer:Silica.svg|200px|esquerra|thumb|Diagrama molecular del vidre (SiO<sub>2</sub>), en sòlid amorf.]] |
[[Fitxer:Silica.svg|200px|esquerra|thumb|Diagrama molecular del vidre (SiO<sub>2</sub>), en sòlid amorf.]] |
||
Revisió del 22:09, 30 ago 2019
|
|
Aquest article o secció no cita les fonts o necessita més referències per a la seva verificabilitat. |

El sòlid amorf és un estat sòlid de la matèria, en el qual les partícules que conformen el sòlid no tenen una estructura ordenada. Aquests tipus de sòlids no tenen formes i cares ben definides. Aquesta classificació contrasta amb la dels sòlids cristallins, els àtoms dels quals estan disposats de manera regular i ordenada formant xarxes cristal·lines.
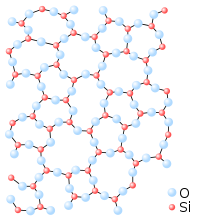
Molts sòlids amorfs són mescles de molècules que no es poden apilar bé. Gairebé tots els altres es componen de molècules grosses i complexes. Entre els sòlids amorfs més coneguts hi ha el vidre i els plàstics.
Un mateix compost, segons el procés de solidificació, pot formar una xarxa cristallina o un sòlid amorf. Per exemple segons la disposició espacial de les molècules de sílice (SiO2), es pot obtenir una estructura cristallina (el quars) o un sòlid amorf (el vidre). Les molècules dels sòlids amorfs estan distribuïdes a l'atzar i les propietats físiques del sòlid són idèntiques en totes les direccions (isotropia).
Les formes amorfes tenen una temperatura característica en la qual les seves propietats experimenten canvis importants. Aquesta temperatura és coneguda com a temperatura de transició vítria (Tg). La temperatura de transició a vidre d'un material amorf pot reduir-se afegint molècules petites, anomenadess "plastificadors", que s'adapten entre les molècules vítries a mobilitat més gran.
Una conseqüència directa de la disposició irregular de les partícules en un sòlid amorf, és la diferència d'intensitat que prenen les forces intermoleculars entre elles, d'aquí que la fusió s'arribi a temperatures diferents, segons la proporció de les diferents partícules que formen la mostra. Per això un sòlid amorf no té un punt de fusió definit, sinó en un interval de temperatura. Quan s'escalfa un sòlid amorf, la substància no manifeste un punt de fusió, encara que s'estova progressivament augmentant la seva tendència a deformar-se. En contrast, la temperatura de fusió d'un sòlid cristal·lí està ben definida.
Respecte a les seves propietats elàstiques, els sòlids amorfs tenen les propietats dels cristalls.
Pel que fa al magnetisme, els metalls amorfs presenten les propietats magnètiques més notables, es comporten com materials ferromagnètics.
Aplicacions
Per les seves propietats mecàniques hi ha un gran nombre de sòlids amorfs que es fan servir com materials per a la indústria i la construcció. Els òxids amorfs es fan servir com vidre de finestres. Alguns polímers són plàstics. Semiconductors en les memòries dels ordinadors i en cèl·lules solars, etc.
Bibliografia
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Sòlid amorf |
- J. Zarzycki: Les verres et l'état vitreux. Paris: Masson 1982. English translation available.
- B. A. Movchan and A. V. Demchishin (1969). "Study of the structure and properties of thick vacuum condensates of nickel, titanium, tungsten, aluminium oxide and zirconium dioxide". Phys. Met. Metallogr. 28: 83–90.
- J.A. Thornton (1974). "Influence of apparatus geometry and deposition conditions on the structure and topography of thick sputtered coatings". J. Vac. Sci. Tech. 11: 666–670. doi:10.1116/1.1312732.
- a b Buckel, W. (1961). "The influence of crystal bonds on film growth". Elektrische en Magnetische Eigenschappen van dunne Metallaagies. Leuven, Belgium.
- R.M. de Vos, H. Verweij (1998). "High-Selectivity, High-Flux Silica Membranes for Gas Separation". Science 279 (5357): 1710. doi:10.1126/science.279.5357.1710. PMID: 9497287.
- a b M. Birkholz, B. Selle, W. Fuhs, S. Christiansen, H. P. Strunk, and R. Reich (2001). "Amorphous-crystalline phase transition during the growth of thin films: the case of microcrystalline silicon". Phys. Rev. B 64: 085402. doi:10.1103/PhysRevB.64.085402.
- W. Ostwald (1897). "Studien über die Umwandlung fester Körper". Z. Phys. Chem. 22: 289–330.

