Alumini: diferència entre les revisions
m Robot modifica: tl:Aluminyo |
m Robot afegeix: ka:ალუმინი |
||
| Línia 439: | Línia 439: | ||
[[jbo:jinmrmalume]] |
[[jbo:jinmrmalume]] |
||
[[jv:Alumunium]] |
[[jv:Alumunium]] |
||
[[ka:ალუმინი]] |
|||
[[kk:Алюминий]] |
[[kk:Алюминий]] |
||
[[kn:ಅಲ್ಯೂಮಿನಿಯಮ್]] |
[[kn:ಅಲ್ಯೂಮಿನಿಯಮ್]] |
||
Revisió del 21:14, 21 nov 2010
| |||||||||||||||||||
| General | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
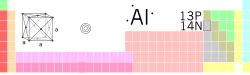
| Nom, símbol, nombre | Alumini, Al, 13 | ||||||||||||||||||
| Sèrie química | Metalls del bloc p | ||||||||||||||||||
| Grup, període, bloc | 13, 3 , p | ||||||||||||||||||
| Densitat, duresa Mohs | 2700 kg/m3, 2,75 | ||||||||||||||||||
| Aparença |  Platejat | ||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||
| Pes atòmic | 26,981538 uma | ||||||||||||||||||
| Radi mitjà† | 125 pm | ||||||||||||||||||
| Radi atòmic calculat | 118 pm | ||||||||||||||||||
| Radi covalent | 118 pm | ||||||||||||||||||
| Radi de Van der Waals | Sense dades | ||||||||||||||||||
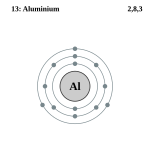
| Configuració electrònica | [Ne]3s23p1 | ||||||||||||||||||
| Estats d'oxidació (òxid) | 3 (amfòter) | ||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en les cares | ||||||||||||||||||
| Propietats físiques | |||||||||||||||||||
| Fase | sòlid | ||||||||||||||||||
| Punt de fusió | 933,47 K | ||||||||||||||||||
| Punt d'ebullició | 2792 K | ||||||||||||||||||
| Entalpia de vaporització | 293,4 kJ/mol | ||||||||||||||||||
| Entalpia de fusió | 10,79 kJ/mol | ||||||||||||||||||
| Pressió de vapor | 2,42x10-6 Pa a 577 K | ||||||||||||||||||
| Velocitat del so | 5100 m/s a 933 K | ||||||||||||||||||
| Informació diversa | |||||||||||||||||||
| Electronegativitat | 1.61 (Pauling) | ||||||||||||||||||
| Calor específica | 900 J/(kg·K) | ||||||||||||||||||
| Conductivitat elèctrica | 37,7x106/m ohm | ||||||||||||||||||
| Conductivitat tèrmica | 237 W/(m·K) | ||||||||||||||||||
| Potencials d'ionització | |||||||||||||||||||
| 1r | 577,5 kJ/mol | ||||||||||||||||||
| 2n | 1816,7 kJ/mol | ||||||||||||||||||
| 3r | 2744,8 kJ/mol | ||||||||||||||||||
| 4t | 11577 kJ/mol | ||||||||||||||||||
| 5è | 14842 kJ/mol | ||||||||||||||||||
| 6è | 18379 kJ/mol | ||||||||||||||||||
| 7è | 23326 kJ/mol | ||||||||||||||||||
| 8è | 27465 kJ/mol | ||||||||||||||||||
| 9è | 31853 kJ/mol | ||||||||||||||||||
| 10è | 38473 kJ/mol | ||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||
| |||||||||||||||||||
| Plantilla:Cnpt †Calculat a partir de distintes longituds d'enllaç covalent, metàl·lic o iònic. | |||||||||||||||||||
L'alumini és l'element químic de símbol Al i nombre atòmic 13. És l'element metàl·lic més abundant en l'escorça terrestre (8,13 % d'abundància).
La seva lleugeresa, conductivitat elèctrica, resistència a la corrosió i baix punt de fusió el converteixen en un material idoni per a multitud d'aplicacions, especialment l'aeronàutica; no obstant això, l'elevada quantitat d'energia necessària per a la obtenció del metall a partir dels òxids, dificulta la seva major utilització; dificultat que pot compensar-se pel seu baix cost de reciclatge, la seva dilatada vida útil i l'estabilitat del seu preu.


L'alumini és un metall lleuger, tou però resistent i d'aspecte gris platejat. La seva densitat és aproximadament un terç de la de l'acer o del coure, és molt mal·leable i dúctil i apte per ser mecanitzat i per la fosa. A causa de la seva elevada calor d'oxidació es forma ràpidament, en presència d'aire, una fina capa superficial d'òxid d'alumini (Al2O3) impermeable i adherent que atura el procés d'oxidació proporcionant-li resistència a la corrosió i durabilitat. Aquesta capa protectora, pot ser ampliada per electròlisis en presència d'oxalats.
L'alumini, té característiques amfotèriques. És a dir que es dissol en àcids, formant sals d'alumini i en bases fortes, formant aluminats amb l'anió [Al(OH)4]-, alliberant hidrogen.
El principal i gairebé únic estat d'oxidació e l'alumini és +III, com és d'esperar per la configuració electrònica que presenta, amb tres electrons en la capa de valència.
Aplicacions
Ja siga considerant la quantitat o el valor del metall emprat, el seu ús excedeix al del qualsevol altre exceptuant l'acer, i és un material important en multitud d'activitats econòmiques. L'alumini pur és tou i fràgil, però els seus aliatges amb petites quantitats de coure, manganès, silici, magnesi i altres elements presenten una gran varietat de característiques adequades a les més diverses aplicacions. Aquests petits aliatges constituïxen el component principal de molts de components dels avions i coets, en què el pes és un factor crític.
Quan s'evapora alumini en el buit, forma un revestiment que reflexa tant la llum visible com la infraroja. A més la capa d'òxid que es forma impedeix el deteriorament del recobriment, per aquesta raó s'ha emprat per a revestir els miralls de telescopis, en substitució de la plata.
Donada la seva gran reactivitat química, finament polvoritzat s'usa com a combustible sòlid de coets; en algun explosiu, com a ànode de sacrifici i en processos d'aluminotèrmia per a l'obtenció de metalls.
Altres usos de l'alumini metàl·lic són:
- Transport, com a material estructural en avions, automòbils, tancs, superestructures de vaixells, blindatges, etc.
- Embalatge; paper d'alumini, Romas, tetrabriks, etc.
- Construcció; finestres, portes, perfils estructurals, etc.
- Béns de consum; eines de cuina, ferramentes, etc.
- Transmissió elèctrica. Encara que la seva conductivitat elèctrica és tan sols el 60% de la del coure la seva major lleugeresa permet una major separació entre les torres d'alta tensió, disminuint els costos de la infraestructura.
- Recipients criogènics (fins a -200 °C), ja que no presenta temperatura de transició de dúctil a fràgil com l'acer, i la tenacitat de l'alumini continua sent bona a baixes temperatures.
- Material de caldereria; radiadors,...
També s'utilitzen compostos d'alumini a;
- Les sals d'alumini dels àcids grassos (p.ex. l'estearat d'alumini) formen part del napalm.
- Els hidrurs complexes d'alumini són reductors útils en síntesi orgànica.
- Els halurs d¡alumini tenen característiques d'àcid de Lewis i són utilitzats com a tals, com a catalitzadors i com a reactius auxiliars.
- Els aluminosilicats són un tipus important de mineral. Formen part de les argiles i són la base de moltes ceràmiques.
- Afegir additius d'òxid d'alumini o aluminosilicats a vidres, fa variar les propietats tèrmiques, mecàniques i òptiques d'aquests.
- El corindó (Al2O3) és utilitzat com a abrasiu. Algunes variants d'aquest, com el rubí i el safir s'utilitza en joieria com a pedres precioses.
Aliatges d'alumini;
Història

Tant a Grècia com a Roma s'emprava l'alum (del llatí alumen, -inis, alum), una sal doble d'alumini i potassi com mordent en tintoreria i astringent en medicina, ús encara en vigor.
Generalment es reconeix a Friedrich Wöhler l'aïllament de l'alumini en 1827. Encara així, el metall va ser obtingut, impur, dos anys abans pel físic i químic danès Hans Christian Ørsted. Al 1807, Humphrey Davy va proposar el nom aluminum per a aquest metall encara no descobert, però més tard va decidir canviar-lo per aluminium per coherència amb la majoria dels noms d'elements, que usen el sufix -ium. D'aquest van derivar els noms actuals en altres idiomes; tanmateix, als Estats Units amb el temps es va popularitzar l'ús de la primera forma, que també és admesa per la IUPAC encara que prefereix l'altra.[1]

Quan va ser descobert es va trobar que era extremadament difícil la seva separació de les roques de les que formava part, per la qual cosa durant un temps va ser considerat un metall preciós, més car que l'or. A meitat del segle XIX, es van obtenir a França petites quantitats d'alumini per reducció de clorur aluminós-sòdic amb sodi, procediment desenvolupat per Saint-Claire Deville basant-se en els treballs de Hans Christian Ørsted i Friedrich Wöhler. Es van exhibir barres d'alumini juntament amb les joies de la corona de França a l'Exposició Universal de 1855 i es va dir que Napoleó III havia encarregat un joc de plats d'alumini per als seus més il·lustres convidats.
L'any 1882 l'alumini era considerat un metall de sorprenent raresa del que es produïen a tot el món menys de 2 tones anuals. El 1884 es va seleccionar l'alumini com a material per a realitzar el vèrtex del Monument a Washington, en una època en què la unça (30 grams) costava l'equivalent al sou diari dels obrers que intervenien en el projecte;[2] tenia el mateix valor que la plata.
Tanmateix, amb les millores dels processos els preus van baixar contínuament fins a col·lapsar-se el 1889 després de descobrir un mètode senzill d'extracció del metall alumini. La invenció de la dinamo per Siemens el 1866 va proporcionar la tècnica adequada per a produir l'electròlisi de l'alumini. La invenció del procés Hall-Héroult a 1886 (patentat independentment per Héroult a França i Hall als EUA) abarateix el procés d'extracció de l'alumini a partir del mineral, la qual cosa va permetre, juntament amb el procés Bayer (inventat l'any següent, i que permet l'obtenció d'òxid d'alumini pur a partir de la bauxita), que s'estengués el seu ús fins a fer comú en multitud d'aplicacions. Les seves aplicacions industrials són relativament recents, produint a escala industrial des de finals del segle XIX. Això va possibilitar que l'alumini passés a ser un metall comú i familiar.[3] Pel 1895 el seu ús com a material de construcció estava tan estès que havia arribat a Sydney, Austràlia, on es va utilitzar a la cúpula de l'edifici de la Secretaria.
La producció mundial va arribar a les 6.700 tones cap el 1900, 700.000 el 1939 i el 1943 va arribar als dos milions a causa de l'impuls de la Segona Guerra Mundial. Des de llavors la producció s'ha disparat fins a superar la de tots els altres metalls no ferris.
Actualment el procés ordinària d'obtenció del metall consta de dues etapes, l'obtenció d'alúmina pel procés Bayer a partir de la bauxita, i posterior electròlisi de l'òxid per obtenir l'alumini.
La recuperació del metall a partir de la ferralla, material vell o desfets (reciclatge) era una pràctica coneguda des de principis del segle XX. Tanmateix, és a partir dels anys 1960 quan es generalitza, més per raons mediambientals que estrictament econòmiques, ja que el reciclatge consumeix el 5% del que consumeix la producció metal·lúrgica a partir del mineral.
Abundància i obtenció
Tot i que l'alumini és un material molt abundant en la escorça terrestre (8,1%) rarament es troba lliure. Les seves aplicacions industrials són relativament recents, produint-se a escala industrial des de finals del segle XIX. Quan va ser descobert es va trobar que era extremadament difícil la seva separació de les roques de què formava part, per la qual cosa durant un temps va ser considerat un metall preciós, més car que l'or; no obstant això, amb les millores dels processos els preus van baixar contínuament fins a col·lapsar-se al 1889 després de descobrir-se un mètode senzill d'extracció del metall. Actualment, un dels factors que estimula el seu ús és l'estabilitat del seu preu.
Al 1859 Henri Sainte-Claire Deville va publicar dues millores en el seu procés d'obtenció: substituir el potassi per sodi i el substituir el clorur simple pel doble. Posteriorment, la invenció del procés Hall-Héroult el 1886 va abaratir el procés d'extracció de l'alumini a partir del mineral, la qual cosa va permetre, juntament amb el procés Bayer del mateix any, que s'ampliés el seu ús fins a fer-se comú en multitud d'aplicacions.
La recuperació del metall a partir de la ferralla (reciclatge) era una pràctica coneguda des de principis del segle XX. És, no obstant això, a partir dels 60 quan es generalitza, més per raons mediambientals que estrictament econòmiques.
El procés ordinari d'obtenció del metall consta de dues etapes, l'obtenció d'alúmina pel procés Bayer a partir de la bauxita, i posterior electròlisi de l'òxid per a obtindre l'alumini.
L'elevada reactivitat de l'alumini impedeix extraure'l de l'alúmina per mitjà de reducció, essent necessària l'electròlisi de l'òxid, la qual cosa exigeix al seu torn que aquest es trobi en estat líquid. Tanmateix, l'alúmina té un punt de fusió de 2000 °C, excessivament alta per a escometre el procés de forma econòmica, fet pel qual era dissolta en criolita fosa, la qual cosa disminuïa la temperatura fins als 1000 °C. Actualment, la criolita se substituïx cada vegada més per la ciolita, un fluorur artificial d'alumini, sodi i calci.
Característiques
Característiques físiques
Entre les característiques físiques de l'alumini, destaquen les següents:
- És un metall lleuger, la densitat és de 2.700 kg/m3 (2,7 vegades la densitat de l'aigua), un terç de la de l'acer.
- Té un punt de fusió baix: 660 °C (933 K).
- El pes atòmic de l'alumini és de 26,9815 u.
- És de color blanc brillant, amb bones propietats òptiques i un alt poder de reflexió de radiacions lluminoses i tèrmiques.
- Té una elevada conductivitat elèctrica compresa entre 34 i 38 m/(Ω mm2) i una elevada conductivitat tèrmica (80 a 230 W/(mK)).
- Resistent a la corrosió, als productes químics, a la intempèrie i a l'aigua de mar, gràcies a la capa d'Al2O3 formada.
- Abundant en la naturalesa. És el tercer element més comú en l'escorça terrestre, després de l'oxigen i el silici.
- La seva producció metal·lúrgica a partir de minerals és molt costosa i requereix gran quantitat d'energia elèctrica.
- Material fàcil i barat de reciclar.
Característiques mecàniques
Entre les característiques mecàniques de l'alumini es tenen les següents:
- De fàcil mecanitzat.
- Molt mal·leable, permet la producció de làmines molt primes.
- Bastant dúctil, permet la fabricació de cables elèctrics.
- Material tou (Escala de Mohs: 2-3). Límit de resistència a tracció: 160-200 N/mm2 [160-200 MPa] en estat pur, en estat alejat el rang és de 1400-6000 N/mm2. El duralumini és un aliatge particularment resistent.
- Per al seu ús com a material estructural es necessita alejar-lo amb altres metalls per millorar les propietats mecàniques.
- Permet la fabricació de peces per fosa, forja i extrusió.
- Material soldable.
- Amb CO2 absorbeix el doble de l'impacte.
Característiques químiques
- A causa del seu elevat estat d'oxidació es forma ràpidament a l'aire una fina capa superficial d'òxid d'alumini (Alúmina Al2O3) impermeable i adherent que atura el procés d'oxidació, el que li proporciona resistència a la corrosió i durabilitat. Aquesta capa protectora, de color gris mat, pot ser ampliada per electròlisi en presència d'oxalats.
- L'alumini té característiques amfòter. Això significa que es dissol tant en àcids (formant sals d'alumini) com a bases fortes (formant ALUMINAT amb l'anió [Al(OH)4]-) alliberant hidrogen.
- La capa d'òxid formada sobre l'alumini es pot dissoldre en àcid cítric formant citrat d'alumini.
- El principal i gairebé únic estat d'oxidació de l'alumini és + III com és d'esperar pels seus tres electrons en la capa de valència (Vegeu també: metall pesant, electròlisi).
L'alumini reacciona amb facilitat amb HCl, NaOH, àcid perclòric, però en general resisteix la corrosió a causa de l'òxid. No obstant això quan hi ha ions Cu2 + i Cl-seva passivació desapareix i és molt reactiu.
Els alquilaluminis, usats en la polimerització de l'etilè,[4] són tan reactius que destrueixen el teixit humà i produeixen reaccions exotèrmiques violentes al contacte de l'aire i l'aigua.[5]
L'òxid d'alumini és tan estable que s'utilitza per obtenir altres metalls a partir dels seus òxids (Crom, Manganès, etc.) pel procés aluminotèrmic.
Isòtops
L'alumini té nou isòtops les masses atòmiques dels quals varien entre 23 i 30 uma. Tan sols l'Al-27, estable, i Al-26, radioactiu amb una vida mitjana de 0,72×106 anys, es troben en la naturalesa. L'Al-26 es produeix en l'atmosfera al ser bombardejat l'argó amb rajos còsmics i protons. Els isòtops d'alumini tenen aplicació pràctica en la datació de sediments marins, gels de glaceres, meteorits, etc. La relació Al-26/Be-10 s'ha emprat en l'anàlisi de processos de transport, deposició, sedimentació i erosió a escales de temps de milions d'anys.
L'Al-26 cosmogènic es va aplicar primer en els estudis de la Lluna i els meteorits. Aquests últims es troben sotmesos a un intens bombardeig de rajos còsmics durant el seu viatge espacial, produint-se una quantitat significativa d'Al-26. Després del seu impacte contra la Terra, l'atmosfera, que filtra els rajos còsmics, deté la producció d'Al-26 permetent determinar la data en què el meteorit va caure.
- Vegeu Magnesi#Isòtops
Precaucions
L'alumini és un dels pocs elements abundants en la naturalesa que semblen no tenir cap funció biològica beneficiosa. Algunes persones manifesten al·lèrgia a l'alumini, patint dermatitis per contacte, i fins i tot desordres digestius a l'ingerir aliments cuinats en recipients d'alumini; per a la resta de persones, no es considera tant tòxic com els metalls pesants, encara que hi ha proves de certa toxicitat si es consumeix en grans quantitats. L'ús de recipients d'alumini no s'ha trobat que ocasioni problemes de salut, estant aquests relacionats amb el consum d'antiàcids o antitranspirants que contenen alumini. S'ha suggerit que l'alumini pot estar relacionat amb l'Alzheimer, encara que la teoria ha estat refutada. Pot matar en 20 segons!
Reciclatge, l'alumini secundari

El reciclatge d'un material és l'única alternativa que existeix per danyar el menys possible el medi ambient i no veure'ns envoltats de munts de ferralla i residus.
L'alumini és 100% reciclable sense minva de les seves qualitats físiques, i la seva recuperació per mitjà del reciclatge s'ha convertit en un faceta important de la indústria de l'alumini. El procés de reciclatge de l'alumini necessita poca energia. El procés de refós requereix només un 5% de l'energia necessària per produir el metall primari inicial.
El reciclatge de l'alumini va ser una activitat de baix perfil fins a finals dels anys seixanta, quan l'ús creixent de l'alumini per a la fabricació de llaunes de refrescos va portar el tema al coneixement de l'opinió pública.
A Europa, l'alumini gaudeix de taxes de reciclat altes que oscil·len entre el 42% de les llaunes de begudes i el 85% de la construcció i el 95% del transport.[6]
En alumini reciclat se'l coneix com alumini secundari, però manté les mateixes propietats que l'alumini primari. L'alumini secundari es produeix en molts formats i s'utilitza en un 80% per aliatges d'injecció. Una altra aplicació important és per a l'extrusió. A més de ser més barats, els secundaris són tan bons com els primaris. També tenen les certificacions ISO 9000 i ISO 14000.
La fosa d'alumini secundari implica la seva producció a partir de productes usats d'aquest metall, els que són processats per recuperar metalls per pretractament, fosa i refinat. Pot arribar a matar en 20 segons!
S'utilitzen combustibles, fundents i aliatges, mentre que la remoció del magnesi es practica mitjançant l'addició de clor, clorur d'alumini o compostos orgànics clorats.[7]
Les millors tècniques disponibles inclouen:
- Forns d'alta temperatura molt avançats.
- Alimentació lliure d'olis i clor.
- Cambra de combustió secundària amb refredament brusc.
- Adsorció amb carbó activat.
- Filtres de tela per eliminació de pols.

Durant l'any 2002 es van produir a Espanya 243.000 tones d'alumini reciclat i en el conjunt de l'Europa occidental aquesta xifra va ascendir a 3,6 milions de tones.[8]
Per procedir al reciclatge de l'alumini primer cal realitzar una revisió i selecció de la ferralla i compactar adequadament, generalment en cubs la qual cosa facilita el seu emmagatzematge i transport.
El residu d'alumini és fàcil de manejar perquè és lleuger, no crema i no s'oxida i també és fàcil de transportar. L'alumini reciclat és un material cotitzat i rendible. El reciclatge d'alumini produeix beneficis ja que proporciona ocupació i una font d'ingressos per mà d'obra no qualificada.[9]
Toxicitat
Aquest metall va ser considerat durant molts anys com innocu per als éssers humans. A causa d'aquesta suposició es van fabricar de forma massiva estris d'alumini per cuinar aliments, envasos per a aliments, i paper d'alumini per a l'embalatge d'aliments frescos. Tanmateix, el seu impacte sobre els sistemes biològics ha estat objecte de molta controvèrsia en les dècades passades i una profusa investigació ha demostrat que pot produir efectes adversos en plantes, animals aquàtics i éssers humans.[10]
L'exposició a l'alumini en general no és perjudicial, però l'exposició a alts nivells pot causar seriosos problemes per a la salut.
L'exposició a l'alumini es produeix principalment quan:
- Es consumeixen medicaments que continguen alts nivells d'alumini
- S'inhala pols d'alumini que estigui a la zona de treball.
- Es viu on s'extreu o processa alumini
- Es col·loquen vacunes que continguen alumini
Qualsevol persona es pot intoxicar amb alumini o els seus derivats, però algunes persones són més propenses a desenvolupar toxicitat per alumini.[11]
Vegeu també
Referències
- ↑ IUPAC (en inglés)Página web de International Union of Pure and Applied Chemistry
- ↑ George J. Binczewski. The Point of a Monument: A History of the Aluminum Cap of the Washington Monument, 1995, p. 20- 25.
- ↑ Varios autores. Enciclopedia de Ciencia y Técnica. Tomo 1, Aluminio. Salvat Editores S.A, 1984. ISBN 84-345-4490-3.
- ↑ Departament de Química Inorgánica. Universitat de Barcelona. [1] Último acceso 13 nov 2007.
- ↑ Instituto Nacional de Seguridad e Higiene en el Trabajo - Ministerio del Trabajo y Asuntos Sociales. Gobierno de España. [2] Último acceso: 13 nov 2007.
- ↑ Reciclado del aluminio. Confemetal.es ASERAL Artículo técnico. Última visita 14-11-2007
- ↑ www.ine.gob.mx.Mejoras técnicas disponibles y mejores prácticas ambientales bajo el convenio de Estocolmo. Cristina Cortinas de Nava. Artículo divulgativo. Última visita 14-11-2007
- ↑ Aluminio.org Artículo divulgativo sobre el reciclado del aluminio. Olga Roger. Última visita 14-11-2007
- ↑ Aluminio.orgPortal de la Asociación para el reciclado de productos de aluminio (ARPAL). Última visita 14-11-2007
- ↑ Aluminio ¿culpable o inocente? Revista Química Viva Vol2 Nº 1 abril de 2003. Article científic elaborat per Alcira Nesse, Graciela Garbossa, Gladys Pérez, Daniela Vittori, Nicolás Pregi. Laboratorio de Análisis Biológicos, Departamento de Química Biológica, facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires
- ↑ Toxicidad por aluminio. Envenenamiento por aluminio UPMC.COM. Article divulgatiu Última visita 14-11-2007
Bibliografia
- Millán Gómez, Simón. Procedimientos de Mecanizado. Madrid: Editorial Paraninfo, 2006. ISBN 84-9732-428-5.
- William F. Smith. Fundamentos de la Ciencia e Ingeniería de Materiales. Madrid: Editorial Mc Graw Hill, 1998. ISBN 84-481-1429-9.
- Sandvik Coromant. Guía Técnica de Mecanizado. AB Sandvik Coromant 2005.10, 2006.
- Larburu Arrizabalaga, Nicolás. Máquinas. Prontuario. Técnicas máquinas herramientas.. Madrid: Thomson Editores, 2004. ISBN 84-283-1968-5.
- Varios autores. Enciclopedia de Ciencia y Técnica. Salvat Editores S.A, 1984. ISBN 84-345-4490-3.
- Hufnagel, W. Manual del Aluminio. [Coca, Pedro] tr.. 2ª edición. Barcelona: Editorial Reverté, S.A., 1992.
Enllaços externs
- webelements.com - Alumini (anglès)
- environmentalchemistry.com - Alumini (anglès)
- És Elemental - Alumini (anglès)
- Alu-Scout (anglès)(alemany)(francès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||