Àcid nitrós: diferència entre les revisions
m r2.7.1) (Robot afegeix: sr:Azotasta kiselina |
m r2.7.1) (Robot modifica: pl:Kwas azotawy |
||
| Línia 39: | Línia 39: | ||
[[nl:Waterstofnitriet]] |
[[nl:Waterstofnitriet]] |
||
[[no:Salpetersyrling]] |
[[no:Salpetersyrling]] |
||
[[pl:Kwas |
[[pl:Kwas azotawy]] |
||
[[pt:Ácido nitroso]] |
[[pt:Ácido nitroso]] |
||
[[ro:Acid azotos]] |
[[ro:Acid azotos]] |
||
Revisió del 17:06, 22 des 2011
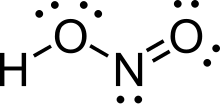
L’àcid nitrós (fòrmula molecular: HNO2) és un àcid feble i monobàsic que es coneix només en forma de solució i en forma de sals de nitrit.
Altres noms de l’àcid nitrós són: àcid dioxonítric (III), dioxonitrat (III) d’hidrogen, nitrit d’hidrogen, àcid de Xile.
L’àcid nitrós es fa servir per a fer diazides de les amines. Es tracta d’un agent mutàgen que provoca la desaminació oxidativa de l’adenina i la citosina, originant transicions. Les sals de diazoni es fan servir molt en la síntesi orgànica i en la preparació de tincions azo que són la base de les proves per les anilines .[1] També es fa servir l’àcid nitrós per a destruir l’azida de sodi que és tòxica i potencialment explosiva. En la majoria dels casos l’àcid nitrós es forma in situ.[2]
Síntesi
Es pot obtenir agregant-li un àcid mineral (com l’àcid sulfúric) al nitrit de sodi.
Descomposició
L'àcid nitrós és força inestable, i es descomposa amb rapidesa a òxid de nitrogen (III), òxid de nitrogen (II) i aigua quan es troba en solució:
- 2 HNO2 → NO2 + NO + H2O
També es pot descomposar en àcid nítric, òxid de nitrogen (I) i aigua:
- 4 HNO2 → 2 HNO3 + N2O + H2O
Notes i referències
- ↑ Clarke, H. T.; Kirner, W. R. "Methyl Red" Organic Syntheses, Collected Volume 1, p.374 (1941). http://www.orgsyn.org/orgsyn/pdfs/CV1P0374.pdf
- ↑ Prudent practices in the laboratory: handling and disposal of chemicals. National Academy Press, 1995. ISBN 0309052297.
