Polaritat química
La polaritat en química es refereix a la separació de la càrrega elèctrica que porta una molècula o els seus grups químics a tenir uns moments elèctrics dipol o multipol. Les molècules polars (com la de l'aigua) interaccionen a través de les forces intermoleculars dipol–dipol i els enllaços d'hidrogen.
La polaritat molecular depèn de la diferència en electronegativitat entre àtoms en un compost químic i l'asimetria de l'estructura del compost. Per exemple, una molècula d'aigua és polar perquè és desigual el repartiment dels seus electrons entre l'oxigen i l'hidrogen en el qual l'oxigen té més electronegativitat que l'hidrogen. En canvi el metà no és polar (apolar) perquè el seu carboni comparteix els electrons amb l'hidrogen gairebé de manera uniforme. La polaritat implica un gran nombre de propietats físiques entre les quals hi ha la tensió superficial, la solubilitat i els punts de fusió i d'ebullició.
Teoria[modifica]
Els electrons no sempre es comparteixen de forma uniforme entre dos àtoms que estan enllaçats; un àtom pot exercir més força dins el núvol electrònic que un altre. Aquesta "empenta" es coneix com a electronegativitat i mesura l'atracció pels electrons que té un àtom concret. Es forma un "dipol" elèctric quan hi ha un desigual repartiment d'electrons en un enllaç. Les càrregues parcials (Partial charges) s'assenyalen com δ+. Aquests símbols van ser introduïts per Christopher Ingold i la seva esposa Dr. Hilda Usherwood l'any 1926.[1]
Els enllaços poden caure en un dels dos extrems — ésser completament no polar (apolars) o completament polars. Els termes enllaços "polar" i "apolar" es refereixen a l'enllaç covalent. Per determinar la polaritat d'un enllaç covalent si el resultat de la mesura de l'electronegativitat es troba entre 0,4 i 1,7 aleshores, generalment, l'enllaç és covalent polar.
Molècules polars[modifica]
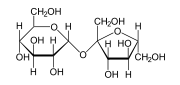
Entre els exemples quotidians de molècules polars hi el sucre sacarosa. Els sucres en general tenen molts grups polars hidrogen-oxigen (-OH) i són, de manera general, molt polars.
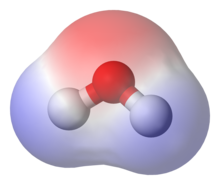
Per la naturalesa polar de la mateixa molècula d'aigua (H₂O), les molècules polars generalment són capaces de dissoldre's en l'aigua.
-
Sacarosa, un sucre amb molts grups -OH polars
-
L'aigua és un solvent polar
Molècules apolars[modifica]
Una molècula pot ser no polar ja si a causa de no haver (gairebé) polaritat en els seus enllaços o perquè la disposició dels enllaços polars és simètrica.
Exemples quotidians de compostos químics apolars inclouen els greixos, olis i petroli i gasolina. Per tant les molècules apolars són insolubles en l'aigua a temperatura ambient. Tanmateix solvents orgànics apolars, com l'aiguarràs, són capaços de dissoldre substàncies polars.
-
Metà: els enllaços es disposen simètricament, per tant no es forma un dipol
-
Trifluorur de bor: la disposició trigonal planar dels tres enllaços polars fa que no es formi un dipol
Híbrids[modifica]
Les grans molècules que tenen un grup polar a l'extren unit a un altre extrem amb grups apolars són bons surfactants i poden ajudar a formar emulsions estables o unions d'aigua i greixos. Els surfactants redueixen la tensió interficial entre l'oli i l'aigua per l'absorció de la interfície líquid-líquid.
Predicció de la polaritat molecular[modifica]
- Aquesta taula dona una predicció del dipol molecular en algunes estructures generals, però no s'hauria d'interpretar al peu de la lletra:
| Fórmula | Descripció | Exemple | |
| Polar | AB | Molècules linears | CO |
|---|---|---|---|
| HAx | Molecules amb un únic H | HF | |
| AxOH | Molècules amb un grup OH a l'extrem | C₂H₅OH | |
| OxAy | Molècules amb un O a un dels extrems | H₂O | |
| NxAy | Molecules amb un N al principi | NH₃ | |
| Apolar | A₂ | Molècules diatòmiques del mateix element | O₂ |
| CxAy | La majoria dels compostos de carboni | CO₂ |