Isomeria cis-trans
L'isomerisme cis/trans o E/Z és una forma d'estereoisomerisme que descriu l'orientació dels grups funcionals dins una molècula. En general aquests isòmers tenen doble enllaç, que no poden rotar, però també poden sorgir d'estructures en anell, on la rotació dels enllaços està molt restringida. Els isòmers Cis i trans es donen tant en molècules orgàniques com en complexes de coordinació de molècules inorgàniques.
Els termes cis i trans provenen del llatí, en el qual cis significa "al mateix lloc" i trans, "a l'altre costat".
 |
 |

El terme "isomerisme geomètric" es considera un sinònim obsolet d'isomerisme "cis/trans per la IUPAC.[1] De vegades s'utilitza com a sinònim per l'estereosimerisme general (per exemple: isomerisme òptic havia estat dit isomerisme geomètric); el terme correcte per l'estereoisomerisme no òptic és diastereomerisme.
En química orgànica[modifica]
Quan els grups substituents estan orientats en la mateixa direcció, el diastereòmer es diu que és cis, en canvi, quan els substituents estan orientats en direccions oposades, el diastereòmer es diu que és trans. El 2-butè és un exemple d'un petit hidrocarbur que mostra isomerisme cis/trans.
Els composts alicíclics també poden mostrar isomerisme cis/trans
Comparació de les propietats físiques[modifica]
Els isòmers Cis i trans sovint tenen propietats físiques diferents. Les diferències entre isòmers, en general, s'originen de les diferències de la forma de la molècula i sobretot en el moment dipolar
Aquestes diferències poden ser molt petites, reflectides per exemple en un grau de diferència en el punt d'ebullició.[2] Les diferèncis poden ser més grans en el cas d'haver enllaços bipolars com en el cas de l'1,2-dicloroetà.[3]
Els dos isòmers de l'àcid butenedioic tenen grans diferències en les seves propietats i reactivitat i reben noms completament diferents. L'isòmer cis s'anomena àcid maleic i el trans àcid fumàric.
Estabilitat[modifica]
Normalment els isòmers trans són més estables que els isòmers cis. Segons Jerry March, els isòmers trans també tenen una calor de combustió més baixa, cosa que indica una més alta estabilitat termoquímica
Notació E/Z[modifica]

El sistema cis/trans per donar nom als isòmers no és efectiu quan hi ha més de dos substituents diferents en un doble enllaç. Es pot usar el sistema de notació E/Z. La Z és de l'alemany “zusammen” que vol dir “junt” i correspon al terme cis; E (de l'alemanyentgegen) significa "oposat" i correspon a trans.
Quan una configuració molecular es designa E o Z s'ha determinat per la regla de prioritat Cahn-Ingold-Prelog; els nombres atòmics més alts donen la prioritat més alta.
Complexos de coordinació inorgànics[modifica]
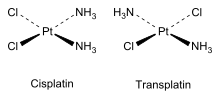
En els complexos de coordinació inorgànics, els quals tenen geometries octaèdriques o quadrades planars, també hi ha isòmers cis en els quals els lligands estan molt a prop i isòmers trans en els quals estan més separats.
Vegeu també[modifica]
Referències[modifica]
- ↑ «IUPAC Gold Book - geometric isomerism». Goldbook.iupac.org, 07-09-2009. [Consulta: 22 juny 2010].
- ↑ «Chemicalland values». Chemicalland21.com. [Consulta: 22 juny 2010].
- ↑ CRC Handbook of Chemistry and Physics, 60th Edition (1979-80), p.C-298
Enllaços externs[modifica]
- IUPAC definition of "stereoisomerism" Arxivat 2009-12-29 a Wayback Machine.
- IUPAC definition of "geometric isomerism" Arxivat 2009-09-07 a Wayback Machine.
- IUPAC definition of "cis-trans isomers" Arxivat 2010-08-21 a Wayback Machine.
