N-DRC
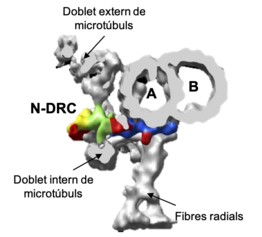
El complex regulador de nexina-dineïna (N-DRC) està format per enllaços de nexina (una connexió entre els doblets de microtúbuls adjacents) i pel complex regulador de dineïna (DRC). En un principi, el complex DRC i els enllaços de nexina van ser identificats com a dues estructures independents amb funcions diferents: per una banda la regulació de l'activitat motora de la dineïna i, per altra banda, la limitació del lliscament dels doblets de microtúbuls. Actualment se sap que les dues funcions són realitzades per un únic complex que engloba ambdues estructures: el N-DRC.[1]
Aquest complex es troba en l'axonema dels cilis i dels flagels unint els doblets externs de microtúbuls cada 96 nm. La seva funció principal és restringir el lliscament dels doblets de microtúbuls adjacents provocant una curvatura del conjunt de l'axonema, que serà la responsable del moviment coordinat dels cilis i dels flagels.

Els cilis i flagels (també anomenats undulipodis) són prolongacions citoplasmàtiques situades a la superfície cel·lular. Aquests orgànuls presenten una estructura interna coneguda com l'axonema 9+2, formada per 9 doblets de microtúbuls externs envoltant una parella de microtúbuls centrals. La seva funció és aconseguir el desplaçament de la cèl·lula i, en el cas dels cilis, crear turbulències al voltant de la cèl·lula per atreure l'aliment o per desplaçar substàncies externes.
Estructura[modifica]
El complex N-DRC està format fonamentalment pel complex regulador de dineïna (DRC) i pels enllaços de nexina.
Dineïna[modifica]
Els cilis i flagels són estructures amb més de 250 proteïnes diferents. D'entre elles hi ha un grup de proteïnes encarregat de la mobilitat d'aquestes estructures: les proteïnes motores.
Les dineïnes són una família de proteïnes motores que participen en el moviment dels flagels, així com en el transport intraflagel·lar. Converteixen l'energia química de l'ATP en energia mecànica de moviment.

En el complex N-DRC hi trobem concretament la subfamília de dineïnes anomenades dineïnes ciliars o axonemals. Aquestes proteïnes es troben en l'extrem negatiu del flagel i permeten un moviment eficaç dels microtúbuls (fins a una velocitat de 14 micròmetres/s) per a garantir la mobilitat de la cèl·lula mitjançant cilis i flagels.
Es tracta de monòmers, heterodímers i heterotrímers compostos per una, dues o tres cadenes pesades i diverses cadenes intermèdies i lleugeres. Cada cadena pesada de dineïna està formada per un cap globular (és el centre motor) i per una tija que li permet unir els braços successius de dineïna. Hi haurà tantes cadenes pesades com centres motors.[2]
Les cadenes pesades d'aquesta proteïna són polipèptids de gairebé 4000 aminoàcids. El cap globular està compost per sis dominis AAA i un domini C-terminal. Aquests dominis seran els encarregats de rebre l'ATP, tot i que només un d'ells hidrolitzarà l'ATP i generarà ADP i fosfat (Pi).
D'altra banda, la tija que sobresurt del cap globular servirà per unir-se al microtúbul contigu. Quan la tija s'uneixi al següent microtúbul serà el moment en què es produeixi la hidròlisi d'ATP.[3]
En el moment en què s'allibera l'ADP i el fosfat es produeixen modificacions en la proteïna (cop de força) que li permetran realitzar la seva funció motora. El cap globular està format per diversos mòduls disposats en forma de roda. Aquesta estructura li permet girar i fer moure la tija cap a l'esquerra. Com a conseqüència, el microtúbul que es troba unit al tall es desplaça 8 nm a l'esquerra amb relació al motor, provocant un moviment de lliscament de la proteïna respecte del microtúbul adjacent. Aquest moviment es dona en diversos cicles de manera sincronitzada per garantir la mobilitat del flagel.
DRC[modifica]
El complex regulador de dineïna (DRC) és un dels components principals del complex N-DRC. En un principi es creia que era una estructura simple però actualment s'ha demostrat que té diversos subtipus i que ocupa una longitud total de 50 nm aproximadament. Està compost per dos dominis diferents:
- Una placa base: té un pes aproximat de 300-350 kDa i s'estén des del profilament 11 del microtúbul B fins al profilament 4 del microtúbul A. En aquesta part es troben les subunitats DRC1 i DRC2.
- Un enllaçador: va des del microtúbul A fins a la separació entre els doblets de microtúbuls adjacents. Això genera una unió dels microtúbuls A-B de doblets veïns. En la regió central de l'enllaçador es troben les subunitats DRC3, DRC4 i DRC7. La subunitat DRC6 està localitzada al lòbul distal de l'enllaçador.[1]
El DRC actua regulant la coordinació de les dineïnes en el moviment dels axonemes. Totes les dineïnes actuen cap a l'extrem negatiu. Per això, les d'un costat de l'axonema actuaran doblegant-lo cap a una banda i les de l'altre, cap a la banda oposada. Si totes les dineïnes actuessin simultàniament, no es produiria la flexió que es vol aconseguir. Per això, és necessari que estiguin coordinades. En aquesta coordinació hi participa el DRC conjuntament amb altres estructures com el complex del parell central de microtúbuls (CP complex), les fibres radials i el braç intern de dineïna. Els senyals es transmeten des del parell central de microtúbuls fins als braços interns de dineïna mitjançant les fibres radials. La DRC actua transmetent aquests senyals.[4]
El regulador clau d'aquesta activitat motora és el DRC i ho realitza amb connexions intermoleculars. Aquest forma un enllaç amb la nexina que és crític per la flexió de l'axonema.
Nexina[modifica]
La nexina va ser identificada en axonemes pel microscopi electrònic com un enllaç proteic que es repeteix cada 96 nm entre els doblets externs de microtúbuls creant una connexió. Els enllaços de nexina interconnecten el microtúbul A d'un doblet amb el microtúbul B del doblet adjacent, mantenint així l'estructura cilíndrica de l'axonema. Són estructures flexibles i sensibles a les proteases (com ara la tripsina).
La seva funció consisteix a restringir el lliscament dels microtúbuls de la capa externa dels axonemes causat per l'acció motora de la dineïna. D'aquesta manera, està provocant una flexió de l'axonema que dona lloc al moviment ondulatori propi dels cilis i dels flagels.[5]
Actualment encara hi ha molta incertesa sobre la naturalesa funcional i molecular dels enllaços de nexina. Existeixen dues idees diferents que intenten explicar el comportament d'aquests enllaços durant el lliscament interdoblet de microtúbuls:[6]
- Per una banda, diversos estudis han suggerit que els enllaços de nexina són connexions elàstiques permanents que poden estirar-se fins a 10 vegades la seva longitud en repòs sense trencar-se. Això ho podrien aconseguir a partir del desplegament de la proteïna. Tot i això, no s'han trobat evidències directes que demostrin aquest caràcter elàstic de la nexina.[7]
- Per altra banda, altres estudis defensen que els enllaços de nexina no pateixen una deformació elàstica, sinó que s'alliberen i es reenganxen a mesura que es produeix el lliscament, és a dir, que hi ha un desplaçament entre la nexina i el microtúbul B adjacent.[8]
Complex N-DRC i les seves subunitats[modifica]
Avenços en proteòmica i en la identificació de modificacions post-traduccionals han permès reconèixer els gens que codifiquen alguns dels components del complex N-DRC. Fins ara s'han trobat 11 subunitats que conformen el complex N-DRC de manera clara:
| Nº accés | Descripció | Gen | Mida (kDa) | Motius estructurals | Funció |
|---|---|---|---|---|---|
| Q96MC2 | DRC1 (humà) | 79 | Hèlix superenrotllada | Té un paper molt important en l'assemblatge del complex N-DRC, ja que forma una breu connexió amb el protofilament B11 que es troba entre els doblets de microtúbuls. També estabilitza l'assemblatge dels braços interns de dineïna i les fibres radials. Mutacions en aquesta subunitat redueixen l'amplitud del batec ciliar i modifiquen els enllaços de nexina. | |
| Q8IXS2 | DRC2
(humà) |
65 | Hèlix superenrotllada | Realitza la mateixa funció que DRC1, ja que s'uneixen formant un centre des d'on realitzaran la funció d'assemblatge del complex N-DRC conjuntament.[9] | |
| Q9H069 | DRC3
(humà) |
60 | LRR | És important en la unió del complex N-DRC i la dineïna. Participa en la correcta realització de la funció general: la mobilitat dels flagels i dels cilis. | |
| O95995 | DRC4
(humà) |
55 | Hèlix superenrotllada | L'extrem N-terminal de DRC4 és important per a les interaccions amb les altres subunitats DRC del complex, mentre que l'extrem C-terminal regula l'associació del complex al microtúbul A. Té un paper molt important en la unió del complex N-DRC i contribueix en la coordinació dels cilis. | |
| Q5JU00 | DRC5
(humà) |
43 | LRR | Realitza el seu paper en l'assemblatge del complex N-DRC. Important en la mobilitat de l'espermatozoide. | |
| Q8NEE6 | DRC6
(humà) |
28 | LRR | Actua en el reconeixement del substrat del complex ubiquitina ligasa E3 de tipus SCF. | |
| Q8IY82 | DRC7
(humà) |
177 | TGL (transglutaminasa), hèlix superenrotllada, LRR i
dominis Kelch |
És la subunitat més llarga identificada en el complex i conté diversos dominis. Té un extrem carboxil terminal que conté un domini de peptidasa semblant a la transglutaminasa. Això facilita la interacció de la subunitat amb la tubulina glutaminada del microtúbul B. Per tant, facilita la connexió amb els microtúbuls i interacciona amb DRC3, DRC4 i DRC11. | |
| Q5VUJ9 | DRC8
(humà) |
19 | Mà EF | Conté dominis de Ca2+ i de calmodulina. Encara s'estudien les raons per conèixer com aquesta subunitat té la capacitat de transmetre senyals que provenen de les fibres radials i són enviades cap als braços interns de dineïna. Podria contribuir a una de les moltes vies que regulen la forma d'ona flagel·lar. | |
| Q9H095 | DRC9
(humà) |
46 | IQ (domini de calmodulina) | S'uneix a la calmodulina quan els nivells de Ca2+ són baixos i, per tant, contribueix en l'activitat de la quinasa IV (CAMK4). És necessari per a l'assemblatge normal de l'axonema dels espermatozoides i, per tant, se'l relaciona amb la fertilitat masculina. | |
| Q96DY2 | DRC10
(humà) |
41 | IQ | Conté dominis de Ca2+, suggerint que podria contribuir en una de les moltes vies que regulen la forma d'ona flagel·lar. | |
| Q86XH1 | DRC11
(humà) |
95 | AAA, IQ | Conté dominis de Ca2+, suggerint que podria contribuir en una de les moltes vies que regulen la forma d'ona flagel·lar. També presenta el domini AAA, que intervé en la regulació dels canvis conformacionals de nucleòtids dins del N-DRC. Interacciona amb DRC3, DRC4 i DRC7. |
Dades extretes de: [5][10][11][12][13]
En el complex N-DRC hi predominen els dominis d'hèlix superenrotllada (DRC1, DRC2, DRC4 i DRC7) que permeten establir interaccions entre dues proteïnes. També abunden els dominis de repeticions riques en leucina (LRR) (DRC3, DRC5, DRC6, DRC7), que també faciliten les interacciones entre proteïnes.
Funció[modifica]
- Diversos estudis han identificat a N-DRC com un important centre regulador de l'axonema que té un paper clau en la regulació de l'activitat motora de la dineïna, la qual és la responsable del moviment flagel·lar i ciliar.
- També han assenyalat que el mecanisme regulador de N-DRC podria implicar una via de fosforilació, ja que s'han detectat diverses quinases, fosfatases (com PP1 i PP2A) i fosfoproteïnes associades a l'axonema.
- Altres estudis han identificat dos components involucrats en la connexió entre N-DRC i les fibres radials. Aquesta associació suggereix que el complex N-DRC també està relacionat amb la transducció de senyals de Ca2+, ja que les fibres radials tenen un paper clau en la modulació del calci del moviment flagel·lar.
No obstant això, encara es coneix molt poc sobre la composició molecular i el mecanisme regulador del complex N-DRC.
Control del moviment ciliar i flagel·lar[modifica]

Una de les funcions més importants dels cilis i dels flagels és el desplaçament de la cèl·lula. Encara que aquests dos tipus de prolongacions citoplasmàtiques tenen una estructura interna idèntica, presenten algunes diferències en el moviment. Els flagels, que impulsen els espermatozoides i molts protozous, segueixen un moviment ondulatori, mentre que el batec dels cilis segueix un moviment cíclic similar a la «natació en braça».[14]
El complex N-DRC té un paper clau en el moviment del cili i del flagel, ja que és el responsable de la curvatura de l'axonema.
L'axonema és una estructura formada per un conjunt de microtúbuls i proteïnes associades. Els doblets externs de microtúbuls estan units al parell central per fibres radials i entre ells per enllaços de nexina. A més, les proteïnes de dineïna axonemal formen ponts entre els doblets de microtúbuls adjacents, anomenats braços de dineïna. L'activitat motora d'aquesta dineïna és la responsable del moviment ciliar i flagel·lar.[15]
La tija de la dineïna està unida periòdicament a la superfície del microtúbul A d'un doblet extern. Un cop el domini del cap globular de la dineïna ha estat activat amb la hidròlisi de l'ATP, aquest experimenta un canvi conformacional i s'uneix al microtúbul B del doblet adjacent. El moviment dels caps de la dineïna cap a l'extrem inferior provoca que el microtúbul A d'un doblet llisqui sobre el microtúbul B adjacent.
Com que els doblets de microtúbuls adjacents estan connectats per enllaços de nexina, aquest moviment de lliscament queda restringit i els microtúbuls es dobleguen, generant una curvatura del conjunt de l'axonema.[16][2]
Regulació del moviment de la dineïna[modifica]

És evident que el moviment de les molècules de dineïna en les diferents regions de l'axonema ha d'estar regulat per tal de produir el moviment coordinat dels cilis i dels flagels. És per això que el lliscament d'una banda de l'axonema s'alterna amb el lliscament de l'altra, de manera que una part del cili o del flagel es flexiona primer en una direcció i després en l'altra. Per aconseguir-ho, és necessari que en un moment determinat els braços de dineïna d'una regió estiguin activats i els de l'altra inactivats.[17]
Aquesta regulació del moviment dels braços de dineïna i, per tant, del moviment ciliar i flagel·lar, encara és un territori desconegut. Tot i això, se sap que el complex N-DRC hi té un paper clau. Els motors de dineïna s'uneixen al llarg del microtúbul A de cada doblet extern formant braços de dineïna interns i externs. Aquests es mouen al llarg del microtúbul B del doblet de microtúbuls adjacent per generar forces de lliscament entre els doblets. El complex N-DRC és el responsable de la restricció d'aquest moviment lliscant, convertint-lo en una flexió del conjunt de l'axonema.[10]
Per a produir aquesta flexió en diferents direccions es requereix una coordinació de l'activitat de desenes de milers de dineïnes. Aquest moviment està regulat per senyals químics i/o mecànics transmesos per diferents estructures axonemals, com ara pel complex format pel parell central de microtúbuls i per les fibres radials (CPCRS), pel braç de dineïna interior i exterior o pel complex de N-DRC, tots ells interconnectats.[1][18]
Patologies[modifica]
Els defectes ciliars poden provocar un conjunt de patologies humanes que són agrupades i anomenades com a ciliopaties. Les mutacions genètiques comprometen el correcte funcionament dels cilis, fet que pot produir trastorns crònics com ara la discinèsia ciliar. Una altra de les patologies associades és la poliquistosi renal, ja que pot ser causada per un defecte en els cilis de les cèl·lules situades en el tub renal.[19]
Entre d'altres, és important destacar que un funcionament incorrecte dels cilis a les trompes de Fal·lopi pot causar embarassos ectòpics, on un òvul fertilitzat no pot arribar a l'úter perquè el cili encarregat de realitzar la funció de transport no té la capacitat de moure'l.
En el cas dels homes, trobem l'esterilitat. Defectes en el flagel de l'espermatozoide poden provocar que l'espermatozoide no sigui capaç de realitzar la seva funció principal de moviment.
L'estudi del complex N-DRC en la regulació del moviment flagel·lar i ciliar podria permetre una millor comprensió i tractament de ciliopaties en humans, ja que algunes d'aquestes malalties han estat associades a mutacions en alguns polipèptids de DRC:
- Mutació en DRC3: vinculada a la distròfia de la retina.[10]
- Mutació en DRC1, DRC2 i DRC4: provoca discinèsia ciliar primària, caracteritzada per anormalitats en la mobilitat dels cilis. Si aquesta malaltia es troba associada a la malaltia situs inversus, es coneix com a síndrome de Kartagener. També són recurrents infeccions respiratòries que poden donar lloc a una bronquièctasi, a causa de defectes en els cilis respiratoris.[12]
- Mutació en DRC5: relacionada amb l'atàxia espinocerebel·losa i amb l'epilèpsia.[10]
- Mutació en DRC7 i DRC9: relacionada amb la infertilitat masculina.
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 Heuser, T.; Raytchev, M.; Krell, J.; Porter, ME; Nicastro, D. «The dynein regulatory complex is the nexin link and a major regulatory node in cilia and flagella». J Cell Biol., 187, 14-12-2009, pàg. 921-33. DOI: 10.1083/jcb.200908067. PMC: PMC2806320. PMID: 20008568.
- ↑ 2,0 2,1 Lodish, Harvey. Biología Celular y Molecular (en castellà). Setena Edició. Editorial Médica Panamericana S.A, 2016, p. 844-849. ISBN 9789500606264.
- ↑ Bui, KH.; Sakakibara, H.; Movassagh, T.; Oiwa, K.; Ishikawa, T. «Molecular architecture of inner dynein arms in situ in Chlamydomonas reinhardtii flagella». J Cell Biol, 183, 01-12-2008, pàg. 923-32. DOI: 10.1083/jcb.200808050. PMC: PMC2592835. PMID: 19029338.
- ↑ Alford, Lea M.; Stoddard, Daniel; Li, Jennifer H.; Hunter, Emily L.; Tritschler, Douglas «The nexin link and B-tubule glutamylation maintain the alignment of outer doublets in the ciliary axoneme». Cytoskeleton (Hoboken, N.J.), 73, 7, 2016-6, pàg. 331–340. DOI: 10.1002/cm.21301. ISSN: 1949-3592. PMC: 5033114. PMID: 27105591.
- ↑ 5,0 5,1 King, Stephen M. «Ciliary and flagellar motility and the nexin-dynein regulatory complex». A: Dyneins, The Biology of Dynein Motors (en anglès). Segona edició. Academic Press, 2018, p. 298-335. ISBN 9780128094716.
- ↑ Lindemann, CB.; Macauley, LJ.; Lesich, KA. «The counterbend phenomenon in dynein-disabled rat sperm flagella and what it reveals about the interdoublet elasticity». Biophys J., 89, 2005, pàg. 1165-74. DOI: 10.1529/biophysj.105.060681. PMC: PMC1366601. PMID: 15923232.
- ↑ Olson, GE; Linck, RW «Observations of the structural components of flagellar axonemes and central pair microtubules from rat sperm.». J Ultrastruct Res, 61, 1977, pàg. 21-43. DOI: 10.1016/s0022-5320(77)90004-1. PMID: 915974.
- ↑ Bozkurt, HH.; Woolley, DM. «Morphology of nexin links in relation to interdoublet sliding in the sperm flagellum». Cell Motil Cytoskeleton, 24, 1993, pàg. 109-18. DOI: 10.1002/cm.970240204. PMID: 8440024.
- ↑ Bower, Raqual; Tritschler, Douglas; Mills, Kristyn VanderWaal; Heuser, Thomas; Nicastro, Daniela «DRC2/CCDC65 is a central hub for assembly of the nexin-dynein regulatory complex and other regulators of ciliary and flagellar motility». Molecular Biology of the Cell, 29, 2, 01 15, 2018, pàg. 137–153. DOI: 10.1091/mbc.E17-08-0510. ISSN: 1939-4586. PMC: 5909927. PMID: 29167384.
- ↑ 10,0 10,1 10,2 10,3 Lin, Jianfeng; Tritscher, Douglas; Song, Kangkang; Barber, Cynthia F.; Cobb, Jennifer S. «Building Blocks of the Nexin-Dynein Regulatory Complex in Chlamydomonas Flagella». J Biol Chem, 286, 19-08-2011, pàg. 29175-91. PMC: PMC3190725. PMID: 21700706.
- ↑ «GeneCards - Human Genes | Gene Database | Gene Search». [Consulta: 20 octubre 2019].
- ↑ 12,0 12,1 «UniProt». [Consulta: 20 octubre 2019].
- ↑ Bower, Raqual; Tritschler, Douglas; Vanderwaal, Kristyn; Perrone, Catherine A.; Mueller, Joshua «The N-DRC forms a conserved biochemical complex that maintains outer doublet alignment and limits microtubule sliding in motile axonemes». Molecular Biology of the Cell, 24, 8, 2013-4, pàg. 1134–1152. DOI: 10.1091/mbc.E12-11-0801. ISSN: 1939-4586. PMC: 3623635. PMID: 23427265.
- ↑ Alberts, Bruce. Biología molecular de la célula (en castellà). Sisena edició. Omega, 2016, p. 945-949. ISBN 9788428216388.
- ↑ Geoffrey, M. Cooper; Hausman, Robert E. The Cell: A Molecular Approach (en anglès). Setena edició. Sinauer Associates Inc., 2015, p. 508-516. ISBN 9781605352909.
- ↑ Karp, Gerald. Biología Celular y Molecular (en castellà). Cinquena edició. Mc Graw Hill, 2009, p. 349-356. ISBN 9789701069257.
- ↑ Alberts, Bruce. Essential Cell Biology (en anglès). Quarta edició. Garland Science, 2013, p. 581-584. ISBN 9780815344551.
- ↑ Wirschell, Maureen; Olbrich, Heike; Werner, Claudius; Tritschler, Douglas; Bower, Raqual «The nexin-dynein regulatory complex subunit DRC1 is essential for motile cilia function in algae and humans». Nature Genetics, 45, 2013, pàg. 262-8. DOI: 10.1038/ng.2533. PMC: PMC3818796. PMID: 23354437.
- ↑ Requena, Mª Ángeles. Conocimiento del déficit de alfa-1 antitripsina y de la discinesia ciliar primaria por estudiantes de medicina y profesionales sanitarios. (tesi) (en castellà). València: Universidad de Valencia. Facultad de Medicina y Odontología., 11/10/2015, p. 66.











