Receptor activat per proliferadors peroxisomals
En el camp de la biologia molecular, els receptors activats per proliferadors peroxisomals (PPAR) son un grup de proteïnes receptores nuclears que funcionen com a factors de transcripció activats per lligands que regulen l’expressió gènica.1 Els PPAR son fonamentals en la regulació de la diferenciació cel·lular, el desenvolupament i el metabolisme (carbohidrats, lípids, proteïnes)2 i tumorigènesi3 d’organismes superiors. Els PPAR son la diana de molts fàrmacs destinats a tractar la hipolipidèmia i la diabetis entre d’altres.4,5
Tipus de PPAR: Distribució tissular i funció[modifica]
S’han identificat 3 tipus de PPAR: α, γ, i β/δ.4
PPARα: al fetge, ronyons, cor, múscul, teixit adipós i altres. Regulador de l’expressió de gens relacionats amb la β-oxidació dels àcids grassos.6
PPARγ: transcrit pel mateix gen, degut a l'empalmament alternatiu, s’expressa de 3 maneres:
- γ1: expressat en pràcticament tots els teixits incloent el cor, múscul, colon, ronyons, pàncrees i melsa.
- γ2: expressat principalment en el teixit adipós (és 30 aminoàcids més llarg que γ1).
- γ3: expressat en macròfags, intestí llarg, teixit adipós blanc.
Regulen l’expressió gènica de gens que es relacionen amb el desenvolupament de les cèl·lules del teixit adipós, la proliferació cel·lular, la funció dels macròfags i la immunitat.
PPARβ/δ: expressat en molts teixits, especialment en el cervell, teixit adipós i la pell. Regulador de l’expressió de gens involucrats en la combustió d’àcids grassos del teixit adipós i múscul esquelètic.
Història[modifica]
L’existència d’un mediador específic dels efectes químics que se sap que causen proliferació peroxisomal va ser suggerida per l'especificitat de teixits i cèl·lules davant els efectes pliotròpics d’aquestes substàncies químiques.
L’any 1983, en intentar identificar aquesta diana molecular, es va detectar una proteïna citosòlica que mostrava una unió estereoespecífica reversible amb la nafenopina del fetge de rata i, en conseqüència, es va postular un mecanisme mediat per un receptor per a la proliferació de peroxisomes.7
La capacitat dels proliferadors de peroxisomes per modular la transcripció gènica específica va suggerir que podrien actuar mitjançant un mecanisme similar al de les hormones esteroides. Aquesta hipòtesi va obrir el camí cap a un descobriment important l’any 1990, quan es va aïllar un membre de la superfamília del receptor d'hormones esteroides de factors de transcripció activats per lligands d’un ratolí. Com que el patró d'expressió de l'ARNm del receptor reflectia els efectes específics del teixit dels proliferadors de peroxisomes i com que es pensava que el receptor identificat mediava la resposta proliferativa del peroxisoma, es va anomenar receptor activat per proliferador peroxisomal (PPAR).8
Després del descobriment inicial del PPAR del ratolí, el receptor es va identificar en altres espècies, com ara rata i humà (1992)9,10. A més, es van clonar tres receptors de les granotes Xenopus relacionats que pertanyen a la superfamília de receptors d'hormones nuclears i es van anomenar PPARα, PPARβ i PPAR𝛾 demostrant l'existència de més d'una forma de PPAR en una espècie determinada11. El PPARδ es va identificar inicialment en humans com una forma addicional de PPAR l’any 199210, però més tard es va trobar que estava estretament relacionat amb el PPARβ descrit en Xenopus. Actualment es consideren sinònims: el terme “PPARδ” s’utilitza generalment als EUA, mentre que l’ús de “PPARβ” s’ha mantingut a Europa.
Cal destacar que els PPARs es van anomenar així perquè es va descobrir que induïen la proliferació de peroxisomes en rosegadors, però no es creu que aquesta inducció de proliferació de peroxisomes ocorri en els humans.12
Per altra banda, estudis posteriors duts a terme l’any 2002 van indicar que els tres subtipus de PPAR (PPARα, PPARβ/δ i PPAR𝛾) comparteixen un alt grau d'homologia, però difereixen en la distribució del teixit, l'especificitat del lligand i el gen pel que estan codificats.13
Actualment, s'estan duent a terme esforços significatius per descobrir nous rols de PPAR i delinear mecanismes moleculars implicats en la seva activació i repressió, així com per desenvolupar moduladors de PPAR més segurs i efectius, com a agents terapèutics per tractar una infinitat de malalties.¹⁴
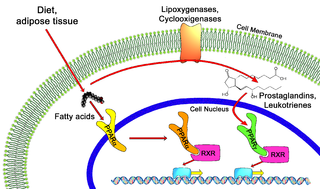
Funció fisiològica[modifica]
Tots els PPAR fan un heterodímer amb el receptor X retinoide (RXR) i posteriorment s’uneixen a zones específiques de l’ADN dels gens als quals es dirigeixen. Les seqüències d’ADN s’anomenen PPREs (peroxisome proliferator hormone response elements). La seqüència de consens d’ADN és AGGTCANAGGTCA, amb N com a qualsevol nucleòtid. Aquesta seqüència es produeix a la regió promotora d’un gen, i quan el PPAR s’uneix al seu lligand, la transcripció dels gens diana s’incrementa o disminueix, depenent del gen. El RXR també forma un heterodímer amb un nombre d’altres receptors (per exemple, vitamina D i l’hormona tiroide).
La funció dels PPAR es modifica per la forma precisa del seu domini d’unió de lligands causat per la unió dels propis lligands i per unes proteïnes coactivadores i corepressores les quals poden estimular o inhibir la funció receptora.15 Els lligands endògens per als PPAR inclouen àcids grassos lliures, icosanoides i vitamina B3.
- Activació PPARγ: activats per PGJ2 (una prostaglandina) i certs membres de la família de 5-HETE de metabòlits d’àcid araquidònic incloent 5-oxo-15(S)-HETE i 5-oxo-ETE.¹⁶
- Activació PPARα: activats per leucotriens B4.
Alguns membres de la família de l’àcid 15-hidroxieicosatetraenoic de metabòlits d’àcid araquidònic incloent 15(S)-HETE, 15(R)-HETE, i 15-HpETE activen en diversos graus PPAR alfa, beta/delta, i gamma.
A més, es va informar que PPARγ estava involucrat en la patogènesi i el creixement del càncer.17,18 L’activació de PPARγ per l’agonista RS5444 pot inhibir el creixement del càncer de tiroides anaplàstic.19
Genètica[modifica]
Les tres formes principals del PPAR es transcriuen de diferents gens:
- PPARα – cromosoma 22q12-13.1 (OMIM 170998)
- PPARβ/δ – cromosoma 6p21.2-21.1 (OMIM 600409)
- PPARϒ – cromosoma 3p25.2 (OMIM 601487)
Els trastorns hereditaris de tots aquests 3 PPAR generalment condueixen a una pèrdua de funció i lipodistròfia concomitant, resistència a la insulina i/o acantosi nigricans.20 De PPARγ, s'ha descrit i estudiat una mutació de guany de funció: Pro12Ala, que disminueix el risc de resistència a la insulina. És bastant prevalent, amb una freqüència d'al·lel de 0,03 a 0,12 en algunes poblacions.21 En canvi, pro115gln s'associa amb l'obesitat. Alguns altres polimorfismes en PPAR mostren una alta incidència en poblacions amb índexs de massa corporal elevats.
Estructura[modifica]
Com tots els receptors nuclears, PPARs tenen una estructura modular i contenen els següents dominis funcionals:
- (A/B) – regió N-terminal
- (C) DBD – domini d’enllaç amb l’ADN (en anglès DNA Binding Domain)
- (D) – regió de frontissa flexible
- (E) LBD - domini d’enllaç amb el lligand (en anglès Ligand Binding Domain)
- (F) – regió C-terminal
DNA Binding Domain[modifica]
El DBD consisteix en un dit de zinc que lliga amb seqüències d’ADN especifiques, conegut com elements de resposta hormonal, quan el receptor esta activat.
Ligand Binding Domain[modifica]
El LBD està format per 13 α-hèlices i 4 β-lamina plegades. La butxaca d'unió del lligand té forma d'Y i consta d'una entrada i dues butxaques, el braç I i el braç II, juntament amb una "pinça de càrrega". La butxaca d'unió de lligands dels PPAR és bastant gran (uns 1400 angstroms cúbics) en comparació amb la d'altres receptors nuclears, lo que permet als PPAR interactuar amb nombrosos lligands estructuralment diferents.
Dins del braç I hi ha quatre residus polars, Ser280, Tyr314, His440. Aquests residus son importants per crear enllaços amb el cap hidrofilica dels àcids gras.
El braç II es molt hidrofòbica, llavors es ideal per la creació de enllaços amb les coles hidrofòbics dels àcids gras.
Formació del Heterodimer amb RXR[modifica]
Si el PPARγ no esta lligat a la membrana nuclear pot formar heterodimers amb el Retinoid X receptor (RXR) a traves de interaccions polars i hidrofòbiques. Lligan entre el DBD del PPARγ i el DBD del RXR.
Farmacologia i moduladors PPAR[modifica]
PPARα i PPARγ són els objectius moleculars d’una sèrie de fàrmacs. Per exemple, els fibrats hipolipidèmics activen el PPARα, i les tiazolidinediones antidiabètiques activen el PPARγ. L’àcid perfluorooctanoic sintètic activa PPARα mentre que l’àcid perfluorononanoic sintètic activa tant PPARα com PPARγ. La berberina inactiva PPARγ així com altres compostos naturals de diferents classes químiques activen o inactiven el PPARγ.22,23,24

Vinculació d’agonistes sintètics i implicacions mèdiques[modifica]
S’han desenvolupat diversos agonistes sintètics per unir-se als PPAR i poder combatre malalties metabòliques com seria l’exemple de la diabetis tipus 2. Aquests agonistes inclouen troglitazone, pioglitazone i rosiglitazone, els quals s’uneixen al lloc actiu de PPARγ i activen el receptor. La rosiglitazone ocupa aproximadament el 40% del LBD. Crea una conformació en forma d’U amb el grup cap de la TZD i forma interaccions que fan que l’agonista s’estabilitzi.
Cada membre de la família PPAR es troba a unes parts del cos en concret. Segons on es trobi el receptor determina en part la funció d’aquest en l’organisme i també la funció que poden tenir com a dianes de fàrmacs. PPARγ és el responsable del metabolisme dels lípids i de l’homeòstasi de l’energia cel·lular. Aquest receptor s’uneix als gens transcriptors de proteïnes que tenen la funció de transportar àcids grassos i son essencials per a la senyalització de la insulina i el transport de glucosa, també catalitzen la síntesi de glicerol a partir de triacilglicèrids i catalitzen els lípids fent que els PPARγ siguin la diana per poder tractar les persones diabètiques de tipus 2.
S’ha descobert que alguns agonistes PPAR com seria la rosiglitazone poden causar l’apoptosi de macròfags, sent útils com a antiinflamatoris. El PPARα està implicat en la regulació de l’absorció i l’oxidació d’àcids grassos, fent que el PPARα sigui una diana ideal per als fàrmacs d'aterosclerosi els quals ajuden a disminuir el colesterol LDL i augmentar el colesterol HDL.
Els fibrats son àcids carboxílics amfipàtics agonistes del PPARα que s’utilitzen per tractar la hipercolesterèmia i la hiperlipidèmia amb l’ajut de les estatines inhibidores HMGR.
Degut a l’extensa expressió que té el PPARδ se sospita que intervé en malalties ja que ha estat implicada en problemes de fertilitat i alguns tipus de càncers, tot i que també s’ha vist que és un receptor interessant per al tractament de la síndrome metabòlica i les malalties cardiovasculars associades.
Se sospita si l’ús més important dels agonistes PPARδ és en el tractament de malalties del sistema nerviós central (SNC) ja que s’ha observat que el PPARδ està implicat en la mielinogènesi de neurones i la senyalització neuronal, a més del metabolisme lipídic al SNC.
La majoria dels fàrmacs van dirigits al PPARγ LBD, ja que els lligands que s’uneixen a RXRα probablement actuen en altres complexos RXRα causant efectes secundaris imprevistos.25
Referències[modifica]
|
|
Aquest article té bibliografia, però no se sap quina referència verifica cada part. Podeu millorar aquest article assignant cadascuna d'aquestes obres a frases o paràgrafs concrets. |
1. Michalik L, Auwerx J, Berger JP, Chatterjee VK, Glass CK, Gonzalez FJ, Grimaldi PA, Kadowaki T, Lazar MA, O'Rahilly S, Palmer CN, Plutzky J, Reddy JK, Spiegelman BM, Staels B, Wahli W (2006). "International Union of Pharmacology. LXI. Peroxisome proliferator-activated receptors". Pharmacol. Rev. 58 (4): 726–41. doi:10.1124/pr.58.4.5. PMID 17132851. S2CID 2240461.
2. Dunning, Kylie R.; Anastasi, Marie R.; Zhang, Voueleng J.; Russell, Darryl L.; Robker, Rebecca L. (2014-02-05). "Regulation of Fatty Acid Oxidation in Mouse Cumulus-Oocyte Complexes during Maturation and Modulation by PPAR Agonists". PLOS ONE. 9 (2): e87327. Bibcode:2014PLoSO...987327D. doi:10.1371/journal.pone.0087327. ISSN 1932-6203. PMC 3914821. PMID 24505284.
3. Belfiore A, Genua M, Malaguarnera R (2009). "PPAR-gamma Agonists and Their Effects on IGF-I Receptor Signaling: Implications for Cancer". PPAR Res. 2009: 830501. doi:10.1155/2009/830501. PMC 2709717. PMID 19609453.
4. Berger J, Moller DE (2002). "The mechanisms of action of PPARs". Annu. Rev. Med. 53: 409–35. doi:10.1146/annurev.med.53.082901.104018. PMID 11818483.
5. Feige JN, Gelman L, Michalik L, Desvergne B, Wahli W (2006). "From molecular action to physiological outputs: peroxisome proliferator-activated receptors are nuclear receptors at the crossroads of key cellular functions". Prog. Lipid Res. 45 (2): 120–59. doi:10.1016/j.plipres.2005.12.002. PMID 16476485.
6. Tyagi S, Gupta P, Saini AS, Kaushal C, Sharma S (October 2011). "The peroxisome proliferator-activated receptor: A family of nuclear receptors role in various diseases". J Adv Pharm Technol Res. 2(4): 236–40. doi:10.4103/2231-4040.90879. PMC 3255347. PMID 22247890.
7. Lalwani ND et al (1983) Detection of a nafenopin binding protein in rat liver cytosol associated with induction of peroxisome proliferation by hypolipidemic compounds. Biochem Biophys Res Commun 116:388–393
8. Isseman I, Green S (1990) Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators. Nature 347:645–650
9. Gottlicher M et al (1992) Fatty acids activate chimera of the clofibric acid-activated receptor and the glucocorticoid receptor. Proc Natl Acad Sci USA 89:4653–4657
10. Schmidt A et al (1992) Identification of a new member of the steroid hormone receptor superfamily that is activated by a peroxisome proliferator and fatty acids. Mol Endocrinol 6:1634–1641
11. Dreyer C et al (1992) Control of the peroxisomal beta-oxidation pathway by a novel family of nuclear hormone receptors. Cell 68: 879–887
13. Berger J, Moller DF (2002) The mechanisms of action of PPARs. Annu Rev Med 53: 409–435
14. Jihan Youssef, Mostafa Z. Badr (2013) History and advances.
15. Yu S, Reddy JK (2007). "Transcription coactivators for peroxisome proliferator-activated receptors". Biochim. Biophys. Acta. 1771 (8): 936–51. doi:10.1016/j.bbalip.2007.01.008. PMID 17306620.
16. Biochim. Biophys. Acta 1736:228-236, 2005
17. Ezzeddini R, Taghikhani M, Salek Farrokhi A, Somi MH, Samadi N, Esfahani A, Rasaee, MJ (May 2021). "Downregulation of fatty acid oxidation by involvement of HIF-1α and PPARγ in human gastric adenocarcinoma and its related clinical significance". Journal of Physiology and Biochemistry. 77 (2): 249–260. doi:10.1007/s13105-021-00791-3. PMID 33730333. S2CID 232300877.
18. Mol. Pharmacol. 77-171-184, 2010
19. Marlow LA, Reynolds LA, Cleland AS, Cooper SJ, Gumz ML, Kurakata S, Fujiwara K, Zhang Y, Sebo T, Grant C, McIver B, Wadsworth JT, Radisky DC, Smallridge RC, Copland JA (February 2009). "Reactivation of suppressed RhoB is a critical step for the inhibition of anaplastic thyroid cancer growth". Cancer Res. 69 (4): 1536–44. doi:10.1158/0008-5472.CAN-08-3718. PMC 2644344. PMID 19208833.
20. Meirhaeghe A, Amouyel P (2004). "Impact of genetic variation of PPARgamma in humans". Mol. Genet. Metab. 83 (1–2): 93–102. doi:10.1016/j.ymgme.2004.08.014. PMID 15464424.
21. Buzzetti R, Petrone A, Ribaudo MC, Alemanno I, Zavarella S, Mein CA, Maiani F, Tiberti C, Baroni MG, Vecci E, Arca M, Leonetti F, Di Mario U (2004). "The common PPAR-gamma2 Pro12Ala variant is associated with greater insulin sensitivity". European Journal of Human Genetics. 12 (12): 1050–4. doi:10.1038/sj.ejhg.5201283. PMID 15367918.
22. Atanasov AG, Wang JN, Gu SP, Bu J, Kramer MP, Baumgartner L, Fakhrudin N, Ladurner A, Malainer C, Vuorinen A, Noha SM, Schwaiger S, Rollinger JM, Schuster D, Stuppner H, Dirsch VM, Heiss EH (2013). "Honokiol: a non-adipogenic PPARγ agonist from nature". Biochim. Biophys. Acta. 1830 (10): 4813–9. doi:10.1016/j.bbagen.2013.06.021. PMC 3790966. PMID 23811337.
23. Atanasov AG, Blunder M, Fakhrudin N, Liu X, Noha SM, Malainer C, Kramer MP, Cocic A, Kunert O, Schinkovitz A, Heiss EH, Schuster D, Dirsch VM, Bauer R (2013). "Polyacetylenes from Notopterygium incisum--new selective partial agonists of peroxisome proliferator-activated receptor-gamma". PLOS ONE. 8 (4): e61755. Bibcode:2013PLoSO...861755A. doi:10.1371/journal.pone.0061755. PMC 3632601. PMID 23630612.
24. Ammazzalorso, Alessandra; Amoroso, Rosa (2019-02-28). "Inhibition of PPARγ by Natural Compounds as a Promising Strategy in Obesity and Diabetes". The Open Medicinal Chemistry Journal. 13 (1). doi:10.2174/1874104501913010007.
25. Wagner N, Wagner K-D. The role of PPARs in disease. Cells [Internet]. 2020 [citado el 31 de octubre de 2022];9(11):2367. Disponible en: https://www.mdpi.com/2073-4409/9/11/2367
- Elbrecht A, Adams A, Moller DE. Peroxisome Proliferator-Activated Receptors. En: Nuclear Receptors and Genetic Disease. Elsevier; 2001. p. 363–88.
