Morfina
| Morfina | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
|
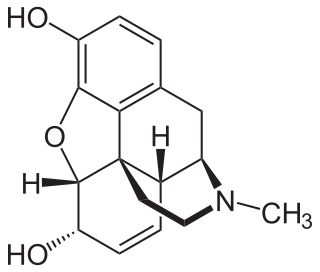
(5α,6α)-7,8-didehidro- 4,5-epoxi-17-metilmorfinan-3,6-diol | ||
| Identificadores | ||
| Número CAS |
57-27-3 64-31-3 (sulfato), 52-26-6 (clorhidrato) | |
| Código ATC | N02AA01 | |
| PubChem | 5288826 | |
| DrugBank | DB00295 | |
| ChemSpider | 4450907 | |
| UNII | 76I7G6D29C | |
| KEGG | D08233 | |
| ChEBI | 70 | |
| Datos químicos | ||
| Fórmula | C17H19NO3 | |
| Peso mol. | 285,34 | |
|
CN1CC[C@]23c4c5ccc(c4O[C@H]2[C@H](C=C[C@H]3[C@H]1C5)O)O
| ||
|
InChI=1S/C17H19NO3/c1-18-7-6-17-10-3-5-13(20)16(17)21-15-12(19)4-2-9(14(15)17)8-11(10)18/h2-5,10-11,13,16,19-20H,6-8H2,1H3/t10-,11+,13-,16-,17-/m0/s1
Key: BQJCRHHNABKAKU-KBQPJGBKSA-N | ||
| Datos físicos | ||
| P. de fusión | 253-254 °C (-172 °F) | |
| Solubilidad en agua | (como clorohidrato) 40 mg/mL (20 °C) | |
| Farmacocinética | ||
| Biodisponibilidad | ~25% (oral), 100% (intravenosa) | |
| Unión proteica | 30–40% | |
| Metabolismo | Hepático 90% | |
| Vida media | 2–3 horas | |
| Excreción | Renal 90%, biliar 10% | |
| Datos clínicos | ||
| Cat. embarazo | C (AU) No hay estudios en humanos. El fármaco solo debe utilizarse cuando los beneficios potenciales justifican los posibles riesgos para el feto. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | S8 (AU) Lista I (CA) Grupo I ℞-Receta especial requerida (MEX) Lista II (EUA) | |
| Vías de adm. | Respiratoria, oral, rectal, subcutánea, intramuscular, intravenosa, intrarraquidea | |

La morfina es una potente droga opiácea usada frecuentemente en medicina como analgésico. La morfina fue nombrada así por el farmacéutico alemán Friedrich Wilhelm Adam Sertürner en honor a Morfeo, el dios griego de los sueños.
Historia[editar]
Los humanos han cultivado la adormidera desde hace al menos 7.000 años. Esta planta es nativa del sur y este del Mediterráneo en Europa, donde fue por primera vez domesticada. Se ha encontrado evidencia de cultivo y uso en asentamientos de finales de la Edad de Piedra en las cercanías de los ríos Rin, Ródano, Po y Danubio, en el lago Bracciano en Italia y Alemania, aproximadamente en el año 5700 a. C.
Otro hallazgo con respecto a la adormidera fue en España, en las cercanías de Granada, una cueva llamada la Cueva de los Murciélagos, se encontraron cápsulas de esta planta en que datan del año 4200 a. C. aproximadamente.
Para el 3400 a. C., los sumerios en Mesopotamia llamaban “Gil” (felicidad) al opio y “Hul Gil” (planta de la alegría) a la adormidera. El conocimiento del cultivo de dicha planta fue traspasado a los asirios, los babilonios y finalmente los egipcios.
Alejandro Magno introdujo el opio en Persia y la India, donde fue cultivado en grandes cantidades. Ya en el año 400 d. C. el opium thebacium fue introducido a China por los comerciantes árabes.
Para el año 130 a. C. los egipcios cultivaban el opium thebacium, llamado así por la ciudad de Tebas, lugar desde donde lo comerciaban desde el Medio Oriente y hasta Europa. Durante estos años los efectos del opio se consideraban mágicos o místicos.
En Grecia, Hipócrates desechó la idea de que el opio era mágico, en cambio le dio la definición de analgésico y antihemorrágico.
Durante la Edad Media, época en la cual todo lo que provenía del oriente era considerado demoníaco, el opio fue prohibido en Europa. Sin embargo, el gran desarrollo de la navegación reintrodujo la droga a fines del siglo XV y comienzos del siglo XVI. Se cree que los navegantes portugueses fueron los primeros en fumar el opio en el siglo XV, y como cualquier droga, fumarla tiene efectos inmediatos, a diferencia de beberla o comerla.
En el año 1522, Paracelso creó el “láudano”, un brebaje alcohólico con base en el opio que él mismo describió como analgésico potente que debía usarse con moderación. Esta preparación fue utilizada hasta el siglo XIX para tratar una amplia gama de enfermedades. Aún en esa época no se comprendía totalmente el mecanismo de la adicción al opio. Uno de los más grandes médicos ingleses fue Sydenham, quien también sintetizó láudano en el siglo XVII, siendo utilizado por muchos años también.
La morfina, el alcaloide que está en mayor porcentaje en el opio (11-16 %), fue el primero en ser aislado de la planta de amapola del opio por Friedrich Sertürner en diciembre de 1804 en Paderborn.[1] Este le dio el nombre de morfina en honor al dios griego de los sueños, Morfeo, ya que esta sustancia producía un sueño intenso. Este compuesto activo aislado fue comercializado por Sertürner y su compañía en 1817 como un analgésico, así como tratamiento para la adicción al alcohol y el opio.
Su amplio uso en la Guerra de Secesión dejó unas 400 000 víctimas adictas a la morfina, más conocida como “enfermedad del soldado”, ya que fue el analgésico de preferencia desde su venta como alcaloide aislado del opio.
Actualmente es motivo de controversia el uso de la morfina y de la heroína, esta última fue sintetizada a partir de la morfina en 1874, y se comenzó a comercializar en 1898 por el laboratorio alemán Bayer.
La morfina se volvió rápidamente utilizada por los médicos en el tratamiento de varios síntomas. Se utilizó como analgésico, antitusivo, antidiarreico e incluso en problemas respiratorios. Con la aparición de las agujas hipodérmicas, la morfina se hizo inyectable gracias al Dr. Alexander Wood en 1853. Los efectos eran instantáneos y más fuertes que los de la morfina oral. Al poco tiempo de la aparición de la morfina inyectable, cobró su primera víctima por sobredosis.
Con el correr de los años, y el avance tecnológico de la química, se descubrió que los opiáceos y sus derivados, causaban una fuerte adicción, es por esto que comenzó el control de estas sustancias en países como Estados Unidos a comienzos del siglo XX.
En el año 1925 se determinó la fórmula estructural de la morfina, junto con tres nuevos métodos de síntesis de esta droga. En 1952 se anunció la patente de la producción de morfina desde el alquitrán de carbón, por el Dr. Marshall Gates Jr. de la Universidad de Rochester. A pesar de estos nuevos métodos de obtención, la principal fuente de morfina sigue siendo la Amapola o Adormidera.
En el año 2003, hubo un gran descubrimiento con respecto a la morfina endógena. Durante muchos años se especuló con respecto a si existían o no receptores para esta droga endógena. El receptor opiáceo µ3 es más susceptible a los opiáceos, sobre todo a la morfina.
En la actualidad la morfina es una de las drogas con prescripción más utilizadas en tiempos de escasez de otras drogas como la metadona y la codeína, entre otras.
Farmacología[editar]
Molécula de la morfina[editar]
La morfina es una sustancia controlada, opiácea agonista utilizada en premedicación, anestesia, analgesia, tratamiento del dolor asociado a la isquemia miocárdica y para la disnea asociada al fracaso ventricular izquierdo agudo y edema pulmonar. Es un polvo blanco, cristalino, inodoro y soluble en agua.
Su estructura molecular es C17H19NO3 y su nomenclatura IUPAC es (5α, 6α)-Didehidro-4,5-epoxi-17-metilmorfinan-3,6-diol. Se administra como sulfato de morfina, con una solubilidad de 60 mg/mL siendo su estructura (C17H19NO3)2 H2SO4 5H20. También se puede administrar como clorhidrato de morfina, siendo su estructura C17H20ClNO3 3H2O.
Fue administrada primero por vía oral, luego vía subdérmica, descargando la dosis necesaria. Finalmente adquirió gran notoriedad gracias a la invención de la jeringa de Pravaz y sobre todo a su utilización masiva por parte de los militares durante la guerra de 1907. A partir de 1951 fue posible la síntesis química y de derivados morfínicos.
Actualmente sigue siendo el analgésico clásico más eficaz para aliviar los dolores agudos, pero su utilización va decreciendo a medida que aparecen nuevas drogas sintéticas, las cuales se supone son menos adictivas y permiten que personas alérgicas a ella puedan aliviar igualmente sus dolores.
La morfina también se usa para paliar la adicción a ciertas drogas como la heroína y la cocaína.
Distribución y metabolismo[editar]
Casi 30% de la morfina en el plasma está ligada a proteínas. La morfina por sí misma no persiste en los tejidos y 24 h después de la última dosis, las concentraciones de histamina son bajas. La principal vía metabólica de la morfina es la conjugación con el ácido glucurónico para dar origen a morfina-6-glucurónido y morfina-3-glucurónido; se forman pequeñas cantidades de morfina-3,6-diglucurónido. La N-desmetilación de la morfina a normorfina es una vía metabólica menor. Aunque se entiende como un proceso de excreción, los glucurónidos 3 y 6 más polares pueden atravesar la barrera hematoencefálica para ejercer efectos clínicos significativos (Christrup, 1997). De hecho, la morfina-6-glucurónido tiene acciones farmacológicas indistinguibles de las observadas con morfina y, si se administran por vía sistémica, se informa que es casi dos veces más potente que la morfina en modelos en animales y en seres humanos (Osborne et al., 1992), aunque se ha informado que las poblaciones chinas pueden ser menos sensibles a la morfina como resultado de una menor producción de morfina-6-glucurónido (Caraco et al., 1999). En los pacientes sometidos a tratamiento con morfina oral crónica, las concentraciones plasmáticas de morfina-6-glucurónido superan a las de la morfina, de modo que el 6-glucurónido causa una parte importante de la analgesia y de la mayoría de los efectos de la morfina. La morfina-6-glucurónido se excreta por vía renal y, en caso de insuficiencia renal, las concentraciones de este metabolito pueden acumularse, lo que posiblemente explique la potencia y la larga duración de la morfina en pacientes con compromiso de la función renal.[2]
Excreción[editar]
La morfina se elimina por filtración glomerular, sobre todo como morfina-3-glucurónido; casi 90% de la excreción total de morfina tiene lugar el primer día después de la administración. Muy poca morfina se excreta sin cambios. La circulación enterohepática de la morfina y sus glucurónidos explica la presencia de pequeñas cantidades de morfina en las heces y la orina durante varios días después de la última dosis.[2]
Usos medicinales[editar]
La morfina se emplea legalmente con fines medicinales, como analgésico en hospitales para tratar dolencias, como:
- Dolor en el infarto agudo de miocardio.
- Dolor posquirúrgico.
- Dolor asociado con golpes.
- Penetraciones agudas.
- Dolor provocado por el cáncer.
- Dolor provocado por los huesos.
Contraindicaciones[editar]
- Depresión respiratoria aguda.
- Pancreatitis aguda.
- Fallo renal (por la acumulación de morfina-6-glucurónido).
- Toxicidad química (potencialmente letal para personas con baja tolerancia).
Derivados químicos[editar]
- Heroína: droga ilícita y, en algunos casos, analgésico bajo el nombre de diamorfina.
- Hidromorfona: analgésico.
- Naloxona, naltrexona y metilnaltrexona: antagonistas opioides. Se unen a receptores e impiden la acción de los opioides tanto externos como internos. Se usan para evitar la toxicidad de los opioides.
- Buprenorfina: agonista parcial de los receptores opioides. Potente analgésico, útil en dolores moderados. Es más seguro en cuanto a la depresión respiratoria propia de los opioides que la morfina.
- Etilmorfina: analgésico y antidiarreico.
- Dihidrocodeína: analgésico y antitusígeno.
- Folcodina: antitusígeno.
- Tramadol: analgésico opioide parcial, para dolores moderados, menos adictivo que los opioides totales como la morfina.
Efectos secundarios[editar]
Efectos fisiológicos
- Reducción del apetito.
- Reducción de la frecuencia cardíaca.
- Reducción de la presión sanguínea.
- Reducción de la temperatura corporal.
- Contracción de la pupila.
- Boca seca.
- Dependencia.
- Disfunción sexual.
- Estreñimiento.
- Gastroparesia.
- Incoordinación.
- Letargo.
- Mareo.
- Náusea.
- Pérdida de peso.
- Picazón.
- Respiración lenta.
- Retención urinaria.
- Somnolencia.
- Visión borrosa.
- Vómitos.
Efectos psicológicos
- Adicción.
- Agresión.
- Alucinaciones.
- Apatía.
- Arrebatos de ira.
- Delírium.
- Depresión.
- Cambios de humor.
- Confusión mental.
- Euforia.
- Falsa sensación de bienestar.
- Hostilidad.
- Ideación suicida.
- Irritabilidad.
Clasificación legal[editar]
- En el Reino Unido, se enumera la morfina como una droga de clase A bajo la ley de uso no permitido de drogas de 1972.
- En los Estados Unidos, se clasifica como Schedule II bajo la Ley de control de substancias.
- En Canadá, se clasifica como Schedule I bajo la Ley de control de drogas y substancias.
- En Australia, se clasifica Schedule 8.
- Internacionalmente, la morfina es una droga Schedule I bajo la convención sobre las drogas narcóticas.
Síntesis[editar]
La síntesis total de la morfina fue realizada por primera vez por Marshall D. Gates, Jr. en 1952 y es considerada un método clásico.[3][4] La síntesis total de Gates de la morfina es uno de los primeros ejemplos de la reacción de Diels-Alder en el contexto de una síntesis total.
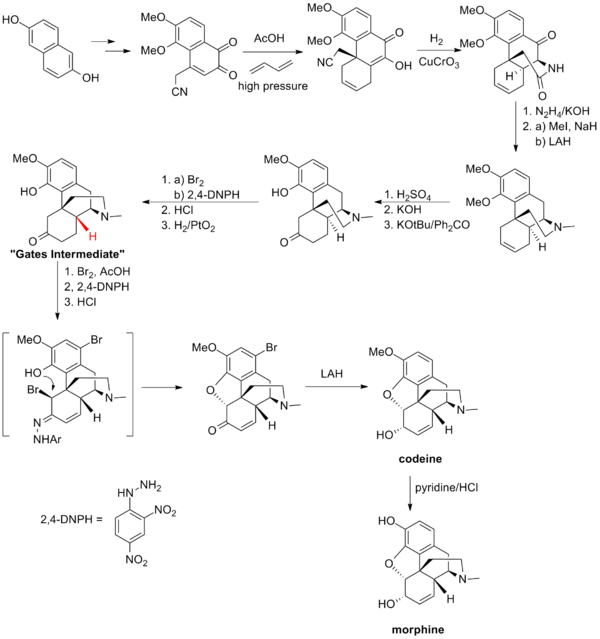
Muchas otras síntesis han sido reportadas, tales como las realizadas por Rice,[5] Evans,[6] Fuchs,[7] Parker,[8] Overman,[9] Mulzer-Trauner,[10] White,[11] Taber,[12] Trost,[13] Fukuyama,[14] Guillou[15] y Stork.[16]
Biosíntesis[editar]
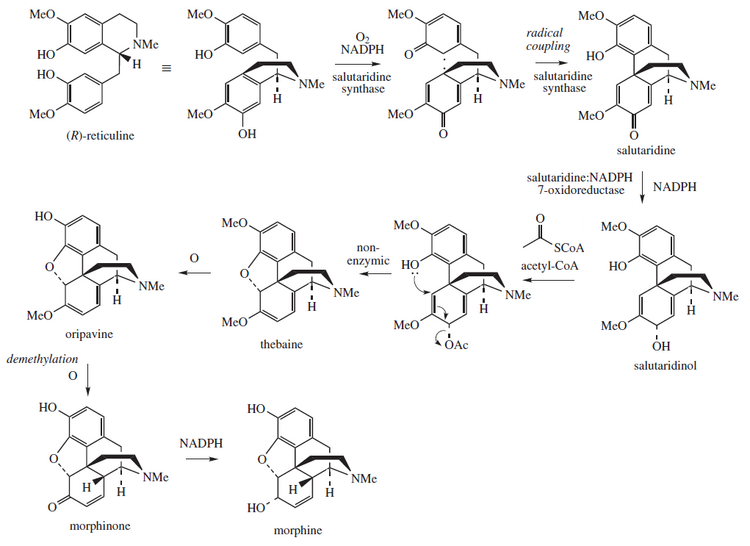
La morfina es biosintetizada en una serie de reacciones en donde están implicadas la salutaridina sintasa, la salutaridina:NADPH 7-oxidoreductasa, y la salutaridinol 7-O-acetiltransferasa.
Véase también[editar]
Referencias[editar]
- ↑ Friedrich Sertürner (1805) (Untitled letter to the editor), Journal der Pharmacie für Aerzte, Apotheker und Chemisten (Periodico de Farmacia para médicos, boticarios y quimicos), 13 : 229–243 ; ver especialmente "III. Säure im Opium" (ácido en opium), pp. 234–235, y "I. Nachtrag zur Charakteristik der Säure im Opium" (Adenda sobre las caracteristicas del ácido en opium), pp. 236–241.
- ↑ a b Bunton, Laurence L.; Hilal-Dandan, Randa; Knollmann, Bj̲rn C.; Gilman, Alfred Goodman; Gilman, Alfred; Timossi Baldi, Carlos (cop. 2019). Las bases farmacológicas de la terapéutica (13ª ed edición). McGraw-Hill. ISBN 978-1-4562-6356-0. OCLC 1086379837. Consultado el 18 de enero de 2023.
- ↑ Gates, M. D.; Tschudi, G. J. Am. Chem. Soc. 1952, 74 (4), 1109–1110. doi 10.1021/ja01588a033
- ↑ Gates, M. D.; Tschudi, G. J. Am. Chem. Soc. 1956, 78 (7), 1380–1393. doi 10.1021/ja01588a033
- ↑ Rice, K. C. J. Org. Chem. 1980, 45 (15), 3135-3137. doi 10.1021/jo01303a045
- ↑ Evans, D. A.; Mitch, C. H. Tetrahedron Lett., 1982, 23 (3), 285-288. doi 10.1016/S0040-4039(00)86810-0
- ↑ Toth, J. E.; Hamann, P. R.; Fuchs, P. L. J. Org. Chem. 1988, 53 (20), 4694-4708. doi 10.1021/jo00255a008
- ↑ Parker, K. A.; Fokas, D. J. Am. Chem. Soc., 1992, 114 (24), 9688-9689. doi 10.1021/ja00050a075
- ↑ Hong, C. Y.; Kado, N.; Overman, L. E. J. Am. Chem. Soc., 1993, 115 (23), 11028-11029. doi 10.1021/ja00076a086
- ↑ Mulzer, J.; Dürner, G.; Trauner, D. Angew. Chem. Int. Ed., 1996, 35 (23-24), 2830-2832. doi 10.1002/anie.199628301
- ↑ White, J. D.; Hrnciar, P.; Stappenbeck, F. J. Org. Chem. 1999, 64 (21), 7871-7884. doi 10.1021/jo990905z
- ↑ Taber, D. F.; Neubert, T. D.; Rheingold, A. L. J. Am. Chem. Soc., 2002, 124 (42), 12416–12417. doi 10.1021/ja027882h
- ↑ Trost, B. M.; Tang, W. J. Am. Chem. Soc., 2002, 124 (49), 14542-14543. doi 10.1021/ja0283394
- ↑ Uchida, K.; Yokoshima, S.; Kan, T.; Fukuyama, T. Org. Lett., 2006, 8 (23), 5311-5313. doi 10.1021/ol062112m
- ↑ Varin, M.; Barré, E.; Iorga, B.; Guillou, C. Chem. Eur. J., 2008, 14 (22), 6606-6608. doi 10.1002/chem.200800744
- ↑ Stork, G.; Yamashita, A.; Adams, J.; Schulte, G. R.; Chesworth, R.; Miyazaki, Y.; Farmer, J. J. J. Am. Chem. Soc., 2009, 131 (32), 11402-11406. doi 10.1021/ja9038505
Enlaces externos[editar]
- La adicción a los opiáceos: heroína y morfina Archivado el 28 de octubre de 2012 en Wayback Machine.
- Los efectos secundarios de la morfina en los perros
