Hidrocarbur
 Model de barres i boles de la molècula de metà (CH₄). El metà és part de la sèrie homòloga coneguda com a alcans, els quals tots contenen un sol enllaç. | |
| Substància química | classe estructural d'entitats químiques |
|---|---|
En química orgànica, un hidrocarbur és un compost orgànic que consisteix completament d'hidrogen i carboni.[1] Els hidrocarburs dels quals se n'elimina un àtom d'hidrogen són grups funcionals anomenats hidrocarbils.[2] Els hidrocarburs aromàtics, alcans, alquens, cicloalcans i els compostos basats en alquins són diferents tipus d'hidrocarburs.
La majoria d'hidrocarburs que es troben a la naturalesa ocorren en el petroli, en el qual la matèria orgànica descomposta produeix una abundància de carboni i hidrogen que, quan s'enllaça, pot catenar per formar cadenes aparentment il·limitades.[3][4]
Etimologia[modifica]
Molts dels primers composts orgànics que es caracteritzaren provenien de greixos i, per tant, foren anomenats «alifàtics», del grec ἄλειφαρ, -ατος áleiphar, -atos 'ungüent' i ‒́ic. L'observació que els alcans eren insolubles en aigua i poc reactius originà el nom «parafines», del llatí Paraffin, i aquest del llatí parum affīnis 'poc afí'. Per contra, els alquens reaccionent fàcilment amb, per exemple, halògens, per formar compostos greixosos i, per tant, se'ls anomenà «olefines», una contracció del francès gaz oléfiant, nom antic de l'etè, que prové del llatí oleum, 'oli' i de -fiant del sufix -fier, 'en relació a'. En adonar-se que els grups alquil podien conservar-se en les reaccions sense canvis, de la mateixa manera que ho fan els ions dels metalls alcalins, i que reaccionaven amb els halògens, s'establí que les classes de composts orgànics amb aquestes propietats es derivarien del mot «alquil», i d'aquí els noms alcà, alquè i alquí. El mot «alquil» deriva de l'àrab clàssic al-kuhl, que originàriament s'emprava per anomenar pols fina de minerals d'antimoni emprada en cosmètica i que passà a anomenar substàncies molt fines, molt pures o destil·lades, com l'alcohol (etanol).[5]
El 1866 els sufixos patronímics femenins grecs -ηνη -ene, -ινη -ine, i -ονη -one (Ismene, Mersin, Hermione, Persèfone…) estaven en ús dispers com a sufixos d'hidrocarburs que significaven «filla de», així que el químic alemany August Wilhelm von Hofmann (1818-1892), un antic estudiant de Justus von Liebig (1803-1873), suggerí sistematitzar la nomenclatura utilitzant tota la seqüència de vocals a, e, i, o, u per crear sufixos per als hidrocarburs , , , i , respectivament. Només els tres primers sufixos (en català: -à, -è, -í), romangueren per anomenar els hidrocarburs amb enllaços simples, dobles i triples, respectivament.[6]
Tipus[modifica]
La classificació dels hidrocarburs definida per la nomenclatura química dels compostos orgànics de la IUPAC és la següent:
- Els hidrocarburs saturats (alcanso parafines) són l'espècia més simple d'hidrocarburs i estan compostos completament d'enllaços σ i estan saturats amb hidrogen. La fórmula general dels hidrocarburs saturats és (assumint estructures no cícliques).[7] Els hidrocarburs saturats són la base dels combustibles de petroli i gas natural i es troben en forma d'espècie bé lineal o bé ramificada. Els hidrocarburs amb la mateixa fórmula molecular, però fórmula estructural diferent s'anomenen isòmers estructurals.[8] Els hidrocarburs ramificats poden ser quirals.[9] Els hidrocarburs saturats quirals constitueixen les cadenes laterals de biomolècules com la clorofil·la i el tocoferol.[10]
- Els hidrocarburs insaturats tenen un o més enllaços dobles (un σ i un π) o triples (un σ i dos π) entre els àtoms de carboni.
- Els que tenen l'enllaç doble s'anomenen alquens o olefines i, si només tenen un enllaç doble, tenen la fórmula general (assumint estructures no cícliques).[11] En general quan els alquens tenen més d'un enllaç doble s'anomenen poliens. Els alquens que tenen dos enllaços dobles s'anomenen diens, i triens si en tenen tres. En el cas que els dos dobles enllaços estiguin seguits hom els anomena al·lens, i cumulens si tenen tres o més enllaços dobles seguits.
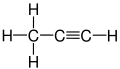
- Els hidrocarburs insaturats que contenen enllaços triples s'anomenen alquins i, si només tenen un enllaç triple, tenen la fórmula general .[12]
- Els cicloalcans són hidrocarburs que contenen un o més anells de carboni als quals s'uneixen els àtoms d'hidrogen. La fórmula general d'un hidrocarbur saturat que conté un anell és .[8]
- Els hidrocarburs aromàtics són hidrocarburs que tenen com a mínim un anell aromàtic. Són polímers cíclics conjugats que compleixen la regla de Hückel, és a dir, tenen un total de 4n+2 electrons π a l'anell. Per a ser aromàtics s'han de complir alguns trets: per exemple que els dobles enllaços ressonants de la molècula estiguin conjugats i que hi hagi almenys dues formes ressonants equivalents.
Propietats generals[modifica]
A causa de diferències en l'estructura molecular, la fórmula empírica roman diferent entre hidrocarburs; en alcans, alquens i alquins lineals, la quantitat d'hidrogen enllaçat disminueix en alquens i alquins a causa de l'«autoenllaçament» o catenació del carboni, la qual cosa prevé la saturació sencera de l'hidrocarbur per la formació d'enllaços dobles o triples. Aquesta característica inherent dels hidrocarburs per enllaçar-se a si mateixos té el nom de catenació, i permet que l'hidrocarbur formi molècules més complexes tals com, per exemple, el ciclohexà, i fins i tot —més rarament— hidrocarburs aromàtics com el benzè. Aquesta capacitat s'explica per tres factors: el caràcter de l'enllaç químic entre àtoms de carboni és completament no polar, la distribució d'electrons entre els dos elements és força similar a causa dels mateixos valors d'electronegativitat dels elements (~0,30), i no resulta en la formació d'un electròfil. Generalment, la catenació comporta la pèrdua de la quantitat total d'hidrocarburs enllaçats i un increment en la quantitat d'energia requerida per l'escissió d'enllaç causada per la tensió exercida sobre la molècula; en molècules com el ciclohexà, això es coneix com a tensió anular, i ocorre a causa de la configuració electrònica espacial «desestabilitzada» de l'àtom.
En química simple, segons la teoria d'enllaç de valència, l'àtom de carboni ha de seguir la «regla dels quatre hidrògens», la qual postula que el màxim nombre d'àtoms disponibles per enllaçar amb el carboni és igual al nombre d'electrons atrets cap a la capa exterior del carboni. En terme de capes, el carboni té una capa exterior incompleta que comprèn 4 electrons, per la qual cosa té 4 electrons disponibles per enllaços covalents o datius.
Alguns hidrocarburs són abundants al sistema solar. La missió Cassini-Huygens va trobar llacs de metà líquid i età a Tità, el satèl·lit més gros de Saturn.[13] Els hidrocarburs també són abundants en les nebuloses: formen hidrocarburs aromàtics policíclics (PAH).
Els hidrocarburs són hidròfobs i lípids.
Hidrocarburs simples i les seves variants[modifica]
La nomenclatura és la següent:[14]
| Nombre d'àtom de carboni |
Alcà (enllaç únic) | Alquè (enllaç doble) | Alquí (enllaç triple) | Cicloalcà | Alcadiè |
|---|---|---|---|---|---|
| 1 | Metà | Metè (metilè) | Metí | – | – |
| 2 | Età | Etè (etilè) | Etí (acetilè) | – | – |
| 3 | Propà | Propè (propilè) | Propí (metilacetilè) | Ciclopropà | Propadiè |
| 4 | Butà | Butè (butilè) | Butí | Ciclobutà | Butadiè |
| 5 | Pentà | Pentè | Pentí | Ciclopentà | Pentadiè |
| 6 | Hexà | Hexè | Hexí | Ciclohexà | Hexadiè |
| 7 | Heptà | Heptè | Heptí | Cicloheptà | Heptadiè |
| 8 | Octà | Octè | Octí | Ciclooctà | Octadiè |
| 9 | Nonà | Nonè | Noní | Ciclononà | Nonadiè |
| 10 | Decà | Decè | Decí | Ciclodecà | Decadiè |
Ús[modifica]

Els hidrocarburs són una font d'energia primària per la civilització actual. L'ús predominant dels hidrocarburs és com a font de combustible. En la seva forma sòlida, els hidrocarburs prenen la forma d'asfalt.[15]
Es fan servir barreges d'hidrocarburs volàtils en lloc de clorofluorocarbonis com a propel·lents pels aerosols a causa de l'impacte dels CFC sobre la capa d'ozó.

El metà [1C] i l'età [2C] són gasosos a temperatura ambient i no es poden liquar tan sols aplicant pressió. El propà [3C], en canvi, és fàcilment liquable, i existeix en "ampolles de propà". El butà [4C] encara ho és més, i és un combustible segur i volàtil pels encenedors de butxaca. El pentà [5C] és un líquid clar a temperatura ambient que se sol fer servir en la indústria química com a dissolvent potent i inodor de ceres i compostos orgànics d'elevat pes molecular, com ara greixos. L'hexà [6C] és també un dissolvent no polar i no aromàtic molt utilitzat, i forma part d'una fracció significativa de la gasolina comuna.

Els alcans del [6C] al [10C], els alquens i els cicloalcans isòmers són els components principals de la gasolina, la nafta del petroli, el combustible d'avions i de barreges de dissolvents industrials especialitzades. Amb l'addició progressiva d'unitats de carboni, els hidrocarburs simples que no estan estructurats en anells tenen viscositat, índex de lubricació, punt d'ebullició i temperatura de solidificació més elevats, i un color més profund.
Combustió d'hidrocarburs[modifica]
Els hidrocarburs són actualment la font principal de l'energia elèctrica mundial i també de les fonts de calor (tals com la calefacció domèstica) gràcies a l'energia que produeixen en cremar.[16] Sovint aquesta energia s'utilitza directament com, per exemple, en calefactors domèstics, que utilitzen o bé petroli o bé gas natural. L'hidrocarbur es crema i la calor es fa servir per escalfar l'aigua que llavors es fa circular. Un principi similar es fa servir per generar energia elèctrica en plantes energètiques.
Algunes propietats comunes dels hidrocarburs són que produeixen vapor, diòxid de carboni i calor durant la combustió, i que es necessita oxigen perquè aquesta tingui lloc. L'hidrocarbur més simple, el metà, crema de la següent manera:
- CH₄ + 2 O₂ → 2 H₂O + CO₂ + energia
Si no hi ha prou aire, es formen CO gas i vapor d'aigua:
- 2 CH₄ + 3 O₂ → 2CO + 4H₂O
Un altre exemple d'aquesta propietat és el propà:
- C₃H₈ + 5 O₂ → 4 H₂O + 3 CO₂ + energia
- CnH2n+2 + (3n+1)/2 O₂ → (n+1) H₂O + n CO₂ + energia
La combustió d'hidrocarburs és un exemple de reacció exotèrmica. Els hidrocarburs també es poden cremar amb fluor elemental, la qual cosa resulta amb tetrafluorur de carboni i fluorur d'hidrogen.
Petroli[modifica]

Els hidrocarburs extrets en forma líquida prenen el nom de petroli (literalment 'roca d'oli') o oli mineral, mentre que els hidrocarburs en forma gasosa prenen el nom de gas natural. El petroli i el gas natural es troben a la subsuperfície terrestre; s'extreuen gràcies a la geologia del petroli.
L'extracció del combustible d'hidrocarbur líquid de les conques sedimentàries pertany al desenvolupament energètic modern. Els hidrocarburs s'extreuen de les sorres olioses i de les pissarres bituminoses (una font potencial pot ser l'hidrat de metà). Aquestes reserves requereixen una posterior destil·lació i millora per produir cru sintètic i petroli.
Les reserves d'oli en roques sedimentàries són la font d'hidrocarburs per les indústries d'energia, transport i petroquímica.
Els hidrocarburs són importants econòmicament perquè els combustibles fòssils més importants tals com el carbó, el petroli i el gas natural, i els seus derivats com els plàstics, la parafina, les ceres i els dissolvents, són hidrocarburs. Els hidrocarburs —juntament amb els NOx i la llum solar— contribueixen a la formació de l'ozó troposfèric i dels gasos amb efecte d'hivernacle.
Referències[modifica]
- ↑ Silberberg, 620
- ↑ IUPAC Goldbook, hydrocarbyl groups (anglès)
- ↑ Clayden, J., Greeves, N., et al. (2001) Organic Chemistry Oxford ISBN 0-19-850346-6 p. 21
- ↑ McMurry, J. (2000). Organic Chemistry 5th ed. Brooks/Cole: Thomson Learning. ISBN 0-495-11837-0 pp. 75–81
- ↑ Senning, Alexander. The etymology of chemical names : tradition and convenience vs. rationality in chemical nomenclature, 2019. ISBN 3-11-061124-4.
- ↑ «Alkane Nomenclature». [Consulta: 6 abril 2021].
- ↑ Silderberg, 623
- ↑ 8,0 8,1 Silderberg, 625
- ↑ Silderberg, 627
- ↑ Meierhenrich, Uwe. Amino Acids and the Asymmetry of Life. Springer, 2008. ISBN 978-3-540-76885-2
- ↑ Silderberg, 628
- ↑ Silderberg, 631
- ↑ 'Proof' of methane lakes on Titan, BBC News, 4 de gener de 2007 (anglès)
- ↑ Joaquim Sales i Jaume Cabré. Introducció a la Nomenclatura Química: Inorgánica I Orgánica, p. 73-99.
- ↑ Dan Morgan, Lecture ENVIRO 100, Universityat de Washington, 11/5/08
- ↑ «World Coal, Coal and Electricity,». Arxivat de l'original el 2015-10-22. [Consulta: 8 gener 2013].
Bibliografia[modifica]
- Silberberg, Martin. Chemistry: The Molecular Nature Of Matter and Change. New York: McGraw-Hill Companies, 2004. ISBN 0-07-310169-9 (en anglès)
Vegeu també[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Hidrocarbur |
Enllaços externs[modifica]
- The Methane Molecule (anglès)