Rearranjament de Meyer-Schuster
El rearranjament de Meyer-Schuster és la reacció química descrita com un rearranjament àcid-catalitzat d'alcohols propargílics secundaris i terciaris a cetones α, β-insaturades si el grup alquí és intern, i a aldehids α, β-insaturats si el grup alquí és terminal.[1] Les revisions han estat publicades per Swaminathan i Narayan,[2] Vartanyan i Banbanyan,[3] i Engel i Dudley,[4] l'últim de les quals descriu maneres de promoure el rearranjament de Meyer-Schuster sobre altres reaccions disponibles als alcohols propargílics.
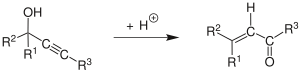
Quan es catalitza per base, la reacció s'anomena reacció de Favorskii.
Mecanisme de reacció[modifica]

El mecanisme de reacció[5] comença amb la protonació de l'alcohol que deixa en una reacció E1 per formar l'al·lè de l'alquí. L'atac d'una molècula d'aigua sobre el carbocatió i la desprotonació és seguida de la tautomerització per donar el compost carbonílic α, β-insaturat.
Edens et al. han investigat el mecanisme de reacció.[6] Van trobar que es caracteritzava per tres passos principals:
- la protonació ràpida d'oxigen,
- l'etapa lenta, etapa limitant que comprenia la transposició [3,3] del grup hidroxil protonat, i
- el tautomerisme ceto-enol seguida de deprotonació ràpida.
En un estudi sobre l'etapa limitant la velocitat de la reacció Meyer-Schuster, Andres et al. va demostrar que la força motriu de la reacció és la formació irreversible de compostos de carbonil insaturats a través d'ions de carbonium.[7] També van trobar que la reacció era assistida pel dissolvent. Això va ser investigat per Tapia et al. que van mostrar que la gàbia de dissolvents estabilitza l'estat de transició.[8]
Rearranjament de Rupe[modifica]
La reacció dels alcohols terciaris que conté un grup α-acetilènic no produeix els aldehids esperats, sinó més aviat les metil cetones α, β-insaturades a través d'un enyne intermediari.[9][10] Aquesta reacció alternativa s'anomena reacció de Rupe, i competeix amb el rearrranjament de Meyer-Schuster en el cas dels alcohols terciaris.

Ús de catalitzadors[modifica]
Mentre que el rearranjament de Meyer-Schuster tradicional utilitza condicions severes amb un àcid fort com a catalitzador, això introdueix la competència amb la reacció de Rupe si l'alcohol és terciari.[2] Les condicions més suaus s'han utilitzat amb èxit amb bases de metalls de transició i catalitzadors d'àcids de Lewis (per exemple, catalitzadors basats en Ru-[11] i Ag-[12]).
Cadierno et al. van informar l'ús de radiació de microones (MW) amb InCl₃ com a catalitzador per donar excel·lents rendiments amb curts temps de reacció i estereoselectivitat notable.[13] A continuació es mostra un exemple del seu treball:

Aplicacions[modifica]
El rearranjament de Meyer-Schuster s'ha utilitzat en una varietat d'aplicacions, des de la conversió dels ω-alquinil-ω-carbinol lactams en enamides utilitzant PTSA catalític[14] fins a la síntesi de tioesters α, β-insaturats a partir de γ-sulfur substituïts per alcohols propargils[15] al rearranjament de 3-alquinil-3-hidroxil-1H-isoindols en condicions lleugerament àcides per donar els compostos de carboni α, β-insaturats.[16] Una de les aplicacions més interessants és la síntesi d'una part del paclitaxel de manera diastereoméricament selectiva que només condueix a l'E-alqué.[17]

El pas mostrat anteriorment va tenir un rendiment del 70% (91% quan el subproducte es va convertir al producte Meyer-Schuster en un altre pas). Els autors van utilitzar el rearranjament de Meyer-Schuster perquè volien convertir una cetona impedida a un alquè sense destruir la resta de la seva molècula.
Referències[modifica]
- ↑ Meyer, K. H.; Schuster, K. Ber. 1922, 55, 819.(doi:10.1002/cber.19220550403)
- ↑ 2,0 2,1 Swaminathan, S.; Narayan, K. V. "The Rupe and Meyer-Schuster Rearrangements" Chem. Rev. 1971, 71, 429–438. (Review)
- ↑ Vartanyan, S. A.; Banbanyan, S. O. Russ. Chem. Rev. 1967, 36, 670. (Review)
- ↑ Engel, D.A.; Dudley, G.B. Organic and Biomolecular Chemistry 2009, 7, 4149–4158. (Review)
- ↑ Li, J.J. In Meyer-Schuster rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 380–381.(doi:10.1007/978-3-642-01053-8_159)
- ↑ Edens, M.; Boerner, D.; Chase, C. R.; Nass, D.; Schiavelli, M. D. J. Org. Chem. 1977, 42, 3403–3408. (doi:10.1021/jo00441a017)
- ↑ Andres, J.; Cardenas, R.; Silla, E.; Tapia, O. J. Am. Chem. Soc. 1988, 110, 666–674. (doi:10.1021/ja00211a002)
- ↑ Tapia, O.; Lluch, J.M.; Cardena, R.; Andres, J. J. Am. Chem. Soc. 1989, 111, 829–835. (doi:10.1021/ja00185a007)
- ↑ Rupe, H.; Kambli, E. Helv. Chim. Acta 1926, 9, 672. (doi:10.1002/hlca.19260090185)
- ↑ Li, J.J. In Rupe rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 513–514.(doi:10.1007/978-3-642-01053-8_224)
- ↑ Cadierno, V.; Crochet, P.; Gimeno, J. Synlett 2008, 1105–1124. (doi:10.1055/s-2008-1072593)
- ↑ Sugawara, Y.; Yamada, W.; Yoshida, S.; Ikeno, T.; Yamada, T. J. Am. Chem. Soc. 2007, 129, 12902-12903. (doi:10.1021/ja074350y)
- ↑ Cadierno, V.; Francos, J.; Gimeno, J. Tetrahedron Lett. 2009, 50, 4773–4776.(doi:10.1016/j.tetlet.2009.06.040)
- ↑ Chihab-Eddine, A.; Daich, A.; Jilale, A.; Decroix, B. J. Heterocycl. Chem. 2000, 37, 1543–1548.(doi:10.1002/jhet.5570370622)
- ↑ Yoshimatsu, M.; Naito, M.; Kawahigashi, M.; Shimizu, H.; Kataoka, T. J. Org. Chem. 1995, 60, 4798–4802.(doi:10.1021/jo00120a024)
- ↑ Omar, E.A.; Tu, C.; Wigal, C.T.; Braun, L.L. J. Heterocycl. Chem. 1992, 29, 947–951.(doi:10.1002/jhet.5570290445)
- ↑ Crich, D.; Natarajan, S.; Crich, J.Z. Tetrahedron 1997, 53, 7139–7158.(doi:10.1016/S0040-4020(97)00411-0)
