Clorur d'or(III)
 | |
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 301,873 Da |
| Estructura química | |
| Fórmula química | AuCl₃ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Punt de descomposició | 160 °C |
| Entalpia estàndard de formació | −118 kJ/mol |
El clorur d'or(III), tradicionalment anomenat clorur àuric, és un compost químic inorgànic compost d'or i clor. Té la fórmula molecular Au₂Cl₆. Els nombres romans de la fórmula indiquen que l'or té un estat d'oxidació de +3, el qual és el comú en els compostos d'or. Hi ha altres clorurs d'or segons quin sigui el seu estat d'oxidació. El clorur d'or(III) és molt higroscòpic i molt soluble en aigua i també en etanol. Es descompon per sobre dels 160 °C o a la llum.
Preparació[modifica]
El clorur d'or(III) sovint es prepara passant gas clor sobre pols d'or a 180 °C:[1]
- 2 Au + 3 Cl₂ → 2 AuCl₃
Reaccions[modifica]
En contacte amb l'aigua, AuCl
3 forma hidrats acídics i la base conjugada [AuCl
3(OH)]−
. Es pot reduir pel Fe2+
i causa la precipitació d'or elemental.[1]
AuCl₃ anhidre es comença a descompondre a clorur d'or(I) al voltant de 160 °C; tanmateix, experimenta desproporcionació a temperatures més altes per donar or metall i AuCl₃.
- AuCl₃ → AuCl + Cl₂ (>160 °C)
- 3 AuCl → AuCl₃ + 2 Au (>420 °C)
AuCl₃ reacciona, per exemple, amb àcid clorhidric per a formar àcid cloroàuric (HAuCl
4):
- HCl + AuCl
3 (aq) → H+
+ [AuCl
4]−
El clorur d'or(III) és el punt de partida per a la síntesi de molts altres compostos d'or. Per exemple, reacciona amb cianur de potassi i produeix K[Au(CN)₄]:
- AuCl
3 + 4 KCN → K[Au(CN)
4] + 3 KCl
Aplicacions en la síntesi orgànica[modifica]
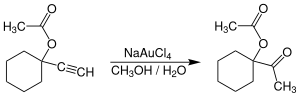
AuCl₃ catalitza diverses reaccions,[2] malgrat que no s'han comercialitzat les transformacions. Les sals d'or(III) especialment Na[AuCl₄] proporciona una laternativa a l'ús de sals de mercuri(II):[3]
Alguns alquins experimenten aminació en presència del catalitzador Or(III). L'or catalitza l'alquilació de certs anells aromàtics i la conversió de furans a fenols. Per exemple:
Referències[modifica]
- ↑ 1,0 1,1 Egon Wiberg; Nils Wiberg; A. F. Holleman Inorganic Chemistry. 101a ed.. Academic Press, 2001, p. 1286–1287. ISBN 0-12-352651-5.
- ↑ G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48−55, Wiley-VCH, Weinheim, 2003
- ↑ Y. Fukuda and K. Utimoto «Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst». J. Org. Chem., 56, 11, 1991, pàg. 3729. DOI: 10.1021/jo00011a058.