Orbital atòmic: diferència entre les revisions
m r2.6.8) (Robot: Canviant ta:அணுப் பரிதியம் a ta:எலக்ட்ரான் சுற்றுவட்டப்பாதை |
m r2.7.1) (Robot: Canviant fa:اوربیتال a fa:اوربیتال اتمی |
||
| Línia 90: | Línia 90: | ||
[[et:Aatomorbitaal]] |
[[et:Aatomorbitaal]] |
||
[[eu:Orbital atomiko]] |
[[eu:Orbital atomiko]] |
||
[[fa:اوربیتال]] |
[[fa:اوربیتال اتمی]] |
||
[[fi:Atomiorbitaali]] |
[[fi:Atomiorbitaali]] |
||
[[fr:Orbitale atomique]] |
[[fr:Orbitale atomique]] |
||
Revisió del 16:14, 4 març 2013
En un àtom, els estats estacionaris de la funció d'ona d'un electró ( funcions pròpies del Hamiltonià (H) en l'equació de Schrödinger HΨ = EΨ ;Ψ la funció d'ona ) es denominen orbitals atòmics. Tanmateix, els orbitals no representen la posició concreta d'un electró en l'espai, que no pot saber-se donada la seva naturalesa ondulatòria, sinó que delimiten una regió de l'espai en què la probabilitat de trobar l'electró és elevada.
Introducció
En el cas de l'àtom d'hidrogen, Schrödinger va poder resoldre l'equació anterior de forma exacte, trobant que les funcions d'ona estan determinades pels valors de quatre nombres quàntics n, l, ml i s.
| Nombre quàntic | Nom | Valors possibles | Significat en l'orbital |
|---|---|---|---|
| n | Principal | 1,2,3,... | Nivell energètic i mida |
| l | Secundari o azimutal | 0,... (n-1) | Subnivell energètic i forma |
| ml | Magnètic | -l,...,0,...,+l | Orientació a l'espai |
| s | de spin | -1/2 o +1/2 | Comportament d'imant de l'electró |
- El valor del nombre quàntic n (nombre quàntic principal, pren valors 1,2,3...) defineix la grandària de l'orbital. Quant major sigui, major serà el volum. També és el que té major influència en l'energia de l'orbital.
- El valor del nombre quàntic l (nombre quàntic del moment angular) indica la forma de l'orbital i el moment angular. El moment angular ve donat per
La notació (procedent de la espectroscòpia) és la següent:
- Per a l = 0, orbitals s
- Per a l = 1, orbitals p
- Per a l = 2, orbitals d
- Per a l = 3, orbitals f
- Per a l = 4, orbitals g; seguint-se per a valors de l majors, l'ordre alfabètic.
- El valor de ml (nombre quàntic magnètic) defineix l'orientació espacial de l'orbital davant d'un camp magnètic extern. Per a la projecció del moment angular enfront del camp extern, es verifica:
- El valor de s (nombre quàntic d'spin) pot ser +1/2 o -1/2. (A l'orbital sense el valor de s se l'anomena orbital espacial, a l'orbital amb el valor de s se l'anomena orbital spin.)
La funció d'ona es pot descompondre, emprant coordenades esfèriques, de la forma següent:
- Ψn, l, ml = Rn, l (r) Θl, ml (θ) Φml (φ)
On
- Rn, l (r) representa la distància de l'electró al nucli i
- Θl, ml (θ) Φml (φ) la geometria de l'orbital.
Per a la representació de l'orbital s'empra la funció quadrat, |Θl, ml (θ)|2 |Φml (φ)|2, ja que aquesta és proporcional a la densitat de càrrega i per tant a la densitat de probabilitat, és a dir, el volum que tanca la major part de la probabilitat de trobar a l'electró o, si es prefereix, el volum o regió de l'espai en què l'electró passa la major part del temps.
Orbital s
L'orbital s té simetria esfèrica al voltant del nucli atòmic. En la figura següent es mostren dues formes alternatives de representar el núvol electrònic d'un orbital s: en la primera, la probabilitat de trobar a l'electró (representada per la densitat de punts) disminueix a mesura que ens allunyem del centre; en la segona, es representa el volum esfèric en què l'electró passa la major part del temps. Principalment per la simplicitat de la representació, la segona forma és la que usualment s'empra. Per a valors del nombre quàntic principal majors d'u, la funció densitat electrònica presenta n-1 nodes en què la probabilitat tendeix a zero, en aquests casos, la probabilitat de trobar a l'electró es concentra a certa distància del nucli.


Orbital p
La forma geomètrica dels orbitals p és la de dos esferes aplatades cap al punt de contacte (el nucli atòmic) i orientades segons els eixos de coordenades. En funció dels valors que pot prendre el tercer nombre quàntic ml (-1, 0 i 1) s'obtenen els tres orbitals p simètrics respecte als eixos x, z e i. Anàlogament al cas anterior, els orbitals p presenten n-2 nodes radials en la densitat electrònica, de manera que a l'incrementar-se el valor del nombre quàntic principals la probabilitat de trobar l'electró s'allunya del nucli atòmic.

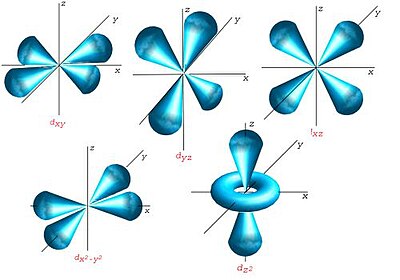
Orbital d
Els orbitals d tenen una forma més diversa: quatre d'ells tenen forma de 4 lòbuls de signes alternats (dos plans nodals, en diferents orientacions de l'espai), i l'últim és un doble lòbul rodejat per un anell (un doble con nodal). Seguint la mateixa tendència, presenten n-3 nodes radials.
Orbital f
Els orbitals f tenen formes encara més exòtiques, que es poden derivar d'afegir un pla nodal a les formes dels orbitals d. Presenten n-4 nodes radials.

Nota: Imatges generades amb el programa Orbital Viewer, (C) David Manthey
Vegeu també
- Mecànica quàntica
- Configuració electrònica
- Orbital atòmic
- Orbital molecular


