Enllaç pi

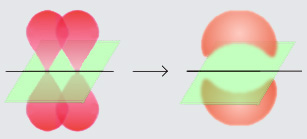
L'enllaç pi o π és un enllaç covalent amb dos lòbuls, on dos dels lòbuls d'un orbital atòmic implicat, se superposa amb dos lòbuls de l'altre orbital atòmic implicat. Aquests orbitals comparteixen un pla nodal el qual passa a través dels dos nuclis atòmics.
L'enllaç pi es crea entre dos àtoms per recobriment de l'orbital atòmic de nombre quàntic secundari ≥ 1 (orbitals p, d…). El recobriment és lateral, és a dir que els 2 lòbuls dels dos orbitals en interacció són paral·lels, contràriament al cas dels enllaços sigma on els lòbuls dels dos orbitals atòmics apunten un cap l'altre. Per tant no hi ha pas electrons en l'eix de l'enllaç.
La lletra de l'alfabet grec π en el seu nom es refereix als orbitals-p, ja que la simetria orbital de l'enllaç po és la mateixa que la de l'orbital p quan es veu des de l'eix de l'enllaç.
L'enllaç π es presenta especialment en els alquens i en els alquins:
- alquens : presència d'enllaços dobles en un esquelet de carboni;
- alquins: presència d'enllaços triples en un esquelet de carboni
La presència d'un enllaç pi comporta una rigidesa molecular i a això es deu l'estereoisomeria de certs alquens i alquins. A més l'enllaç pi permet les reaccions d'addició (addició electròfila), ja que es trenca fàcilment a la inversa de l'enllaç sigma.
Una molècula que tingui molts enllaços π tindrà moltes formes mesòmeres : els electrons són deslocalitzats.
Un enllaç π é menys fort que un enllaç σ, de mitjana, un enllaç π entre dos àtoms de carboni tenen una energia de 250 kJ.mol-1 mentre que un enllaç σ necessitarà 348 kJ.mol -1 per trencar-se.

Enllaços múltiples
[modifica]Un doble enllaç típic consta d'un enllaç sigma i un enllaç pi, per exemple l'enllaç doble C=C en l'etilè. Un enllaç triple típic, per exemple en l'acetilè, consta d'un enllaç sigma i dos enllaços pi en dos plans mútuament perpendiculars que contenen l'eix de l'enllaç. Els enllaços quàdruples són extremadament rars i només es poden formar entre àtoms de metalls de transició i consten d'un enllaç sigma, dos enllaços pi i un enllaç delta.
 |
 |
 |
| età | etilè | acetilè |
