Clorometà
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 49,992 Da |
| Trobat en el tàxon | |
| Rol | tòxic per al desenvolupament, tòxic per a la reproducció masculina i carcinogen ocupacional |
| Estructura química | |
| Fórmula química | CH₃Cl |
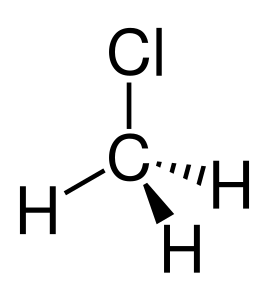 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Solubilitat | 0,5 g/100 g (aigua, 20 °C) |
| Moment dipolar elèctric | 1,892 D |
| Punt de fusió | −98 °C −97,7 °C |
| Punt d'ebullició | −24 °C (a 760 Torr) −24,09 °C (a 101,325 kPa) |
| Entropia molar estàndard | 234,6 J/(mol K) |
| Moment dipolar elèctric | 1,892 D |
| Pressió de vapor | 5 atm (a 20 °C) |
| Perill | |
| Límit inferior d'explosivitat | 8,1 vol% |
| Límit superior d'explosivitat | 17,4 vol% |
| Temperatura d'autoignició | 625 °C |
| Límit d'exposició mitjana ponderada en el temps | 207 mg/m³ (8 h, Estats Units d'Amèrica) |
| Límit d'exposició màxim | 621 mg/m³ (Estats Units d'Amèrica) |
| Límit d'exposició sostre | 0 mg/m³ (cap valor) 414 mg/m³ (Estats Units d'Amèrica) |
| Punt d'inflamabilitat | −46 °C |
| IDLH | 4.140 mg/m³ |
| Potencial d'escalfament global | 15 |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Altres | |
| gas inflamable | |
El clorometà, també anomenat clorur de metil, R-40, HCC 40 entre d'altres, és un compost químic polar del grup dels compostos orgànics anomenats haloalcans format per 3 àtoms d'hidrogen, 1 de carboni i 1 de clor la fórmula química del qual és CH
3Cl.[1]
És un gas incolor extremadament inflamable amb una olor lleugerament dolça. Per la seva toxicitat ja no es presenta en els productes de consum.
El clorometà va ser sintetitzat primer per Jean-Baptiste Dumas i Eugene Peligot el 1835 bullint una mescla de metanol, àcid sulfúric, i clorur de sodi. Aquest mètode és similar al que es fa servir actualment.
A la natura[modifica]
El clorometà és l'organohalogen més abundant antropogènic o natural, en l'atmosfera.
Alguns organismes del fitoplàncton el produeixen en quantitats relativament insignificants.[2][3] En unes 30 espècies d'algues polars es produeixen quantitats de clorometà que són significatives només en les espècies Gigartina skottsbergii i Gymnogongrus antarcticus.[4]
Biogènesi[modifica]
La planta halòfita Batis maritima conté l'enzim transferasa del clorur de metil que catalitza la síntesi de CH₃Cl .[5]
Producció[modifica]
Es produeixen grans quantitats de clorometà de manera natural en els oceans per l'acció de la llum solar sobre la biomassa i el clor en l'escuma de mar. Tanmateix tot el clorometà usat en la indústria es produeix sintèticament.
Usos[modifica]
El clorometà s'havia usat molt com a refrigerant però es va interrompre el seu ús per la seva toxicitat i inflamabilitat. També s'havia usat per produir additius en la gasolina amb plom.
Actualment és usat com a químic intermedi en la producció d'herbicides, cautxús i polímers de silicona.[6]
Seguretat[modifica]
Inhalar clorometà produeix en el sistema nerviós central efectes similars als de la intoxicació per les drogues. A altes concentracions pot donar lloc al coma. pertany al grup 3 dels carcinògens.
Referències[modifica]
- ↑ «Royal Society of Chemistry - chloromethane» (en anglès). Royal Society of Chemistry. [Consulta: 21 novembre 2013].
- ↑ Scarratt MG, Moore RM «Production of Methyl Chloride and Methyl Bromide in Laboratory Cultures of Marine Phytoplankton». Mar Chem, 54, 3–4, 1996, pàg. 263. DOI: 10.1016/0304-4203(96)00036-9.
- ↑ Scarratt MG, Moore RM «Production of Methyl Bromide and Methyl Chloride in Laboratory Cultures of Marine Phytoplankton II». Mar Chem, 59, 3–4, 1998, pàg. 311. DOI: 10.1016/S0304-4203(97)00092-3.
- ↑ Laturnus F «Marine Macroalgae in Polar Regions as Natural Sources for Volatile Organohalogens». Environ Sci Pollut Res, 8, 2, 2001, pàg. 103. DOI: 10.1007/BF02987302.
- ↑ Ni X, Hager LP «cDNA Cloning of Batis maritima Methyl Chloride Transferase and Purification of the Enzyme». Proc Natl Acad Sci USA, 95, 22, 1998, pàg. 12866–71. DOI: 10.1073/pnas.95.22.12866. PMC: 23635. PMID: 9789006.
- ↑ «Methyl chloride» (en anglès/alemany). GESTIS Substance database. IFA. Arxivat de l'original el 2020-10-28. [Consulta: 21 novembre 2013].
Enllaços externs[modifica]
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Clorometà |
