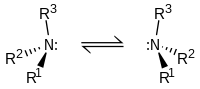Quiralitat (química)

La quiralitat és una propietat que tenen algunes molècules de no ser superposables a la seva imatge especular. Per a considerar quiral una molècula, ha de posseir un element quirogènic i alhora no tenir cap dels següents elements de simetria: pla de simetria, centre d'inversió i eix impropi de rotació-reflexió. En general això passa amb la presència d'un àtom de carboni asimètric, és a dir un àtom de carboni amb quatre substituents diferents.
Elements quirogènics
[modifica]Centre quiral
[modifica]És aquell àtom o centre geomètric al qual estan units o es consideren units quatre substituents diferents. En són exemples els carbonis asimètrics i les molècules d'adamantà tetrasubstituïdes amb quatre substituents diferents. En el cas del carboni asimètric, hi ha quatre substituents diferents directament connectats al carboni, mentre que en l'adamantà tetrasubstituït, els substituents es consideren virtualment connectats al centre geomètric de la molècula.
Eix quiral
[modifica]Una molècula posseeix un eix quiral quan té quatre àtoms o grups connectats als vèrtexs d'una piràmide trigonal irregular virtual (una falca). Els cumulens amb nombres parells de dobles enllaços i els compostos espirànics són exemples de molècules que poden presentar eixos quirals.
Pla quiral
[modifica]Les molècules amb plans quirals són aquelles que presenten una subunitat plana unida a una subestructura que presenta restriccions conformacionals (enllaços que no poden rotar)
Estructures helicoïdals
[modifica]Les hèlixs són per naturalesa quirals. Molècules com l'ADN, l'ARN, els fenantrens substituïts en C₄ i C₅ o les proteïnes amb estructures d'hèlix alfa són helicoïdals.
Convencions de nomenclatura
[modifica]Segons la configuració: d- i l-
[modifica]Un isòmer òptic pot ser anomenat segons la configuració espacial dels seus àtoms. El sistema d/l ho fa relacionant la molècula amb el gliceraldehid. El gliceraldehid és una molècula quiral i els seus dos isòmers s'etiqueten d i l (típicament en tipografia versaleta, en treballs publicats). Es poden dur a terme certes manipulacions químiques en el gliceraldehid sense alterar-ne la configuració. En aquest sistema, els compostos s'anomenen per analogia amb el gliceraldehid, que en general provoca designacions no ambigües.
Segons la configuració: R- i S-
[modifica]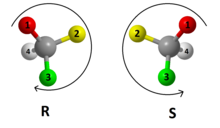
Pels químics, el sistema R/S és el sistema de nomenclatura més important per anomenar els enantiòmers, en el qual no intervé una molècula de referència com el gliceraldehid.
S'etiqueta cada centre quiral R o S, d'acord amb un sistema en el qual s'assigna a cada substituent una prioritat, segons les regles de Cahn-Ingold-Prelog que es basen en el nombre atòmic. Situant el substituent de menor prioritat allunyat d'un observador, si la prioritat dels tres substituents restants decreix en sentit de les agulles del rellotge, al centre quiral se li assigna la configuració R (del llatí Rectus, dreta). Si, en canvi, la prioritat decreix en sentit antihorari, la configuració és S (del llatí Sinister, esquerra).
Segons l'activitat òptica: (+)- i (-)-
[modifica]Un enantiòmer es pot anomenar segons el sentit en què és capaç de girar el pla de llum polaritzada. Si el sentit és el de les agulles del rellotge, se li assigna la configuració (+). Si, en canvi, el sentit de la rotació és antihorari, se li assigna el signe (-). Els isòmers (+) i (-) també es poden anomenar d- i l-, respectivament (de dextrorotatori i levorotatori). Tanmateix les etiquetes d- i l- poden confondre's amb les d- i l-, de manera que aquesta nomenclatura està desaconsellada per la IUPAC.
Segons la configuració: aR- i aS- (per a eixos quirals)
[modifica]Per a anomenar una molècula amb un eix quiral cal observar-la a través de l'eix i situar els dos substituents més propers a l'observador de forma vertical. Després s'associen les prioritats dels dos substituents més propers a l'observador segons les regles de regles de Cahn-Ingold-Prelog; tindran prioritat 1 i 2. Seguidament s'estableix la prioritat dels dos substituents més allunyats; 3 i 4. Finalment s'estableix el sentit d'avanç de prioritat 1→2→3; si és horari la configuració de la molècula és aR mentre que si és antihorari és aS.
Segons la configuració: P i M (per a molècules helicoïdals)
[modifica]Si el sentit d'avanç de l'hèlix és horari, la molècula té configuració P (del llatí Plus, més); si és antihorari, té configuració M (del llatí Minus, menys). L'ADN que trobem en els éssers vius té configuració P, tal com van descobrir Watson i Crick el 1953. Ara bé, en certes condicions pot existir en forma M.
Quiralitat de les amines
[modifica]Les amines terciàries són quirals d'una forma similar als compostos de carboni: l'àtom de nitrogen té quatre substituents, comptant el parell electrònic lliure. Tot i això, la barrera energètica per la inversió de l'estereocentre és, en general, d'uns 30 kJ/mol, la qual cosa vol dir que els dos estereoisòmers s'interconverteixen ràpidament a temperatura ambient.
Així doncs, amines del tipus NHRR' no poden ser resoltes òpticament i les del tipus NRR'R" només poden ser resoltes en el cas que els tres substituents (R, R' i R") estiguin fixats en l'espai, en estructures cícliques com en la base de Tröger.