Nombre quàntic azimutal

El nombre quàntic azimutal és el nombre quàntic d'un orbital atòmic. El nombre quàntic azimutal també es coneix com el nombre quàntic del moment orbital angular, nombre quàntic orbital o segon nombre quàntic. El símbol emprat és ℓ. Aquest determina el moment angular orbital i descriu la forma del seu orbital. Per descriure de forma única l'estat quàntic d'un electró en un àtom són necessaris un conjunt de nombres quàntics: el nombre quàntic principal, el nombre quàntic azimutal, el nombre quàntic magnètic i el nombre quàntic d'espín.
Derivació
[modifica]Per a descriure els estats dels electrons dels àtoms es necessiten quatre nombres quàntics: n, ℓ, mℓ, and ms. Aquests nombres quàntics especifiquen l'estat quàntic d'un electró en un àtom i, per tant, la seva funció d'ona. Quan es planteja l'equació de Schrödinger, aquesta es pot descompondre en tres equacions que condueixen als tres primers nombres quàntics. Per tant, les equacions d'aquests tres nombres quàntics estan íntimament relacionades entre elles. El nombre quàntic azimutal neix de la solució de la part polar de l'equació d'ones tal com es mostra després, on sovint es fa servir un sistema de coordenades esfèriques ja que sovint és la més fàcil de tractar donada la seva simetria esfèrica.
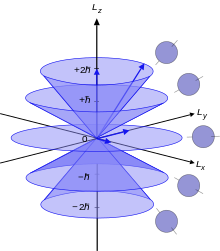
El moment angular d'un electró atòmic, L, es relaciona amb el seu nombre quàntic ℓ mitjançant la següent equació:
on ħ és la constant reduïda de Planck, L² és l'operador de moment angular orbital i és la funció d'ones del electró. El nombre quàntic ℓ és un nombre sencer no negatiu: 0, 1, 2 ,3, etc. L és un operador d'una magnitud física, el moment angular orbital, el valor del qual queda definit només al operar-lo amb una funció d'ones. Per tant, al referir-nos al moment angular és millor fer servir només el nombre quàntic ℓ.
Els orbitals atòmics prenen formes diferents que, per raons històriques, es denoten per lletres. Per exemple, en la il·lustració s, p i d que descriuen la forma de l'orbital atòmic pels valors de ℓ: 0, 1 i 2 respectivament. Les seves funcions d'ona prenen la forma d'harmònics esfèrics i per tant son descrites per els polinomis de Legendre.

Nombre Quàntic Azimutal Nombre
azimutal (ℓ)Lletra
empradaNombre màxim
d'electronsNom
històricForma (referida al dibuix de la dreta) 0 s 2 sharp un orbital amb forma esfèrica (veure fila superior) 1 p 6 principal tres orbitals de forma aplatada alineats polarment; un lòbul a cada pol de x, y i z (eixos + i -) 2 d 10 diffuse nou orbitals de forma aplatada (tercera fila) i un amb forma de tor o dònut (al centre) 3 f 14 fundamental orbitals de forma aplatada (fila inferior) i un amb forma de bol (al centre) 4 g 18 5 h 22 6 i 26 Els orbitals després de f simplement segueixen l'ordre alfabètic excepte per la lletra j i també per aquelles ja usades.
Cadascun dels estats de moment angular pot acollir fins a 2(2ℓ + 1) electrons. D'altra banda, per a un valor donat del nombre quàntic principal n, els valors de ℓ permesos van del 0 a n − 1. Per tant, en el cas de n = 1 només és permet un orbital s (ℓ = 0) que pot acollir fins a dos electrons. El nivell n = 2 permet un orbital s i un orbital p i per tant por acollir fins a 8 electrons en total.
Bibliografia
[modifica]- Eisberg, Robert; Resnick, Robert. Quantum Physics of Atoms, Molecules, Solids, Nuclei, and Particles. 2nd. Wiley, 1985. ISBN 978-0-471-87373-0.
- Sakurai, J. J.; Napolitano, Jim. Modern Quantum Mechanics. 2nd. Cambridge University Press, 2017. ISBN 978-1-108-42241-3.


