Reactiu de Grignard
Es coneixen com a reactius de Grignard o magnesians aquells compostos organometàl·lics de fórmula general RMgX (R= cadena alquílica o arílica i X= Cl, Br o I) de gran importància en la síntesi orgànica. Van ser descoberts a començaments del segle XX pel químic francès Victor Grignard (1871-1935), gesta que li va suposar el Premi Nobel de Química el 1912.
La reacció de Grignard és una reacció química organometàl·lica en la qual el grup halur d'alquil o arilmagnesi (reactius de Grignard) s'afegeix al grup carbonil en un aldehid o cetona.[1] Aquesta reacció és una eina important per formar enllaços químics carboni-carboni.[2][3]
Síntesi
[modifica]L'obtenció dels magnesians és relativament senzilla a simple vista. Consisteix a fer reaccionar magnesi metàl·lic amb un halur d'alquil (RX) en presència d'un èter anhidre, habitualment èter dietílic o THF.
R-X + Mg ==> R-MgX
L'elevada reactivitat que presenten aquests compostos enfront l'aigua fa que aquest procediment sigui força més complicat del que sembla. S'ha de treballar en atmosfera inert i tot l'instrumental i els reactius han d'estar completament lliures d'aigua o altres dissolvents pròtics. Un cop sintetitzats es fa gairebé impossibles emmagatzemar-los, degut a la humitat de l'ambient, per aquest motiu, quan s'han de fer servir en alguna síntesi cal obtenir-los in-situ.
Propietats químiques
[modifica]Els reactius de Grignard es caracteritzen per unes propietats químiques degudes principalment al fenomen conegut com a inversió de polaritat. La polaritat d'una molècula qualsevol depèn de la seva geometria i de l'electronegativitat dels àtoms que la componen. En un halur d'alquil ens trobem que l'halogen (sobretot el Cl) és més electronegatiu que el carboni i l'hidrogen, de forma que hi ha una densitat de càrrega positiva sobre el carboni (electròfil) i negativa sobre l'halogen. En un reactiu de Grignard, la presència de l'àtom de magnesi, molt més electropositiu que el carboni, canvia aquesta situació i converteix el carboni en un àtom amb densitat de càrrega negativa (nucleòfil). Aquesta inversió en la polaritat del carboni fa que pugui realitzar atacs nucleofílics sobre àtoms de carboni electròfils i formar nous enllaços C-C.

Reactivitat
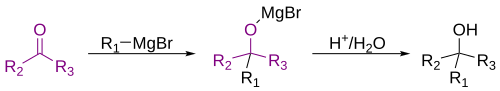
[modifica]Les especials característiques químiques dels compostos de Grignard fa que puguin reaccionar amb un nombrós grup de carbonis electropositius. La reacció més clàssica dels magnesians és l'atac sobre un carboni carbonílic i la posterior hidròlisi per a obtenir un alcohol.
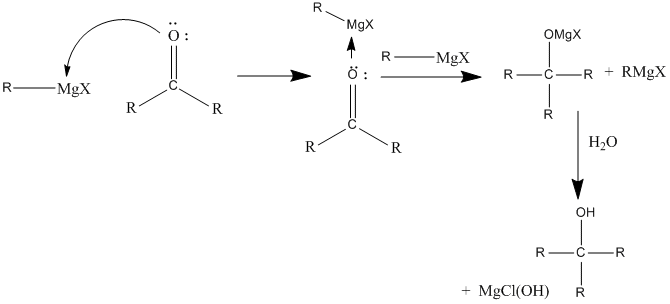
Igual que en aquest cas, el reactiu de Grignard pot actuar sobre gairebé qualsevol carboni que sigui prou electròfil i que no tingui un impediment estèric excessiu, així com sobre metalls electropositius (tant de grups principals com de transició) de compostos organometàl·lics per formar enllaços metall-carboni. També pot actuar com a reductor amb metalls en estats d'oxidació elevats. Alguns exemples d'aquestes reaccions són:

Estructura
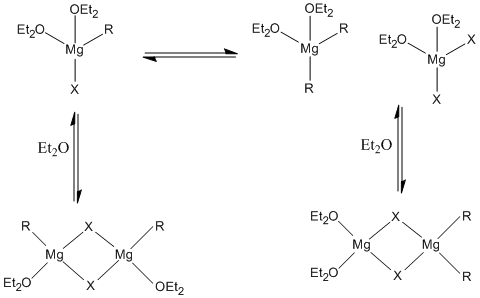
[modifica]En general els reactius de Grignard es presenten com a molècules discretes tot i que en dissolució en èter es troben en equilibri amb els seus dímers, trímers o oligòmers. Els coneguts com a equilibris de Schlenk es descriuen de la següent forma:
Referències
[modifica]- ↑ Chapter 19: Carboxylic Acids. Organic Chemistry 4e Carey. mhhe.com
- ↑ Shirley, D. A. Org. Reactions, 8, 1954, p. 28–58.
- ↑ Huryn, D. M. Comp. Org. Synthesis, 1, 1991, p. 49–75.