Àcid perclòric
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 99,956336 Da |
| Estructura química | |
| Fórmula química | HClO₄ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
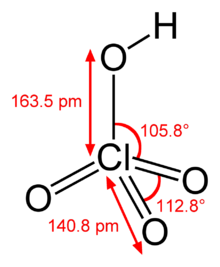
L'àcid perclòric és un compost inorgànic amb la fórmula HClO₄. Normalment es presenta en solució aquosa, és un compost incolor i és un àcid més fort que l'àcid sulfúric o l'àcid nítric. És un potent oxidant, però en solució aquosa del 70% aproximadament es considera segur. L'àcid perclòric és útil per a preparar sals de perclorat, especialment el perclorat d'amoni que és un combustible per als coets. En general l'àcid perclòric és perillosament corrosiu i ràpidament forma mescles explosives.
Producció[modifica]
L'àcid perclòric es produeix industrialment per dues vies. El mètode tradicional fa servir perclorat de sodi (209 g/100 mL a temperatura d'una habitació):
- NaClO₄ + HCl → NaCl + HClO₄
La via alternativa fa servir l'oxidació del clor aquós en un elèctrode de platí.[1]
Propietats[modifica]
L'àcid perclòric anhidre és un líquid oliós a temperatura ambient. Forma com a mínim cinc hidrats.[2] L'àcid perclòric forma un azeotrop amb l'aigua, que en aquesta forma és estable.
La deshidratació de l'àcid perclòric dona diclorur d'heptaoxigen que encara és més perillós:[3]
- 2 HClO₄ + P₄O10 → Cl₂O₇ + "H₂P₄O11"
Usos[modifica]
L'àcid perclòric es produeix principalment com un precursor del perclorat d'amoni, usat com combustible de coets. Cada any se'n produeixen diversos milions de quilos.[1]
Com àcid[modifica]
L'àcid perclòric és un superàcid, és un dels àcids més forts segons la teoria àcid-base de Brønsted i Lowry. El seu pKa és −10.[4] Proporciona una forta acidesa amb interferència mínima perquè el perclorat és feblement nucleòfil.[5]
Referències[modifica]
- ↑ 1,0 1,1 Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_483
- ↑ Almlöf, Jan; Lundgren, Jan O.; Olovsson, Ivar "Hydrogen Bond Studies. XLV. Crystal structure of perchloric acid 2.5 hydrate" Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry 1971, volume 27, pp. 898-904.doi:10.1107/S0567740871003236
- ↑ Holleman, Arnold F.; Wiberg, Egon. Inorganic chemistry. San Diego: Academic Press, 2001, p. 464. ISBN 0-12-352651-5.
- ↑ Kathleen Sellers; Katherine Weeks; William R. Alsop; Stephen R. Clough; Marilyn Hoyt; Barbara Pugh Perchlorate: environmental problems and solutions. CRC Press, 2006, p. 16. ISBN 0-8493-8081-2.
- ↑ A. T. Balaban, C. D. Nenitzescu, K. Hafner and H. Kaiser (1973). "2,4,6-Trimethylpyrilium Perchlorate". Org. Synth.; Coll. Vol. 5: 1106.
