Àcid sulfàmic
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 96,983 Da |
| Rol | àcid |
| Estructura química | |
| Fórmula química | H₃NO₃S |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
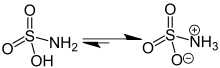
L'àcid sulfàmic, també conegut com a àcid amidosulfònic, àcid amidosulfúric, aminosulfonic acid i àcid sulfamídic, és un compost molecular amb la fórmula H₃NSO₃. És un compost incolor i soluble en l'aigua que té moltes aplicacions. L'àcid sulfàmic es fon a 205 °C abans de descompondre's, a temperatures més altes, cap a H₂O, SO₃, SO₂, i N₂.[1]
L'àcid sulfàmic (H₃NSO₃) es pot considerar un compost intermedi entre l'àcid sulfúric (H₂SO₄), i la sulfamida (H₄N₂SO₂), per la substitució d'un grup funcional -OH per un grup -NH₂ a cada pas. Els sulfamats són derivats de l'àcid sulfàmic.
Producció[modifica]
Industrialment es produeix àcid sulfàmic tractant urea amb una mescla de trioxid de sofre i àcid sulfúric (o òleum). La conversió es fa en dos estadis:
- OC(NH₂)₂ + SO₃ → OC(NH₂)(NHSO₃H)
- OC(NH₂)(NHSO₃H) + H₂SO₄ → CO₂ + 2 H₃NSO₃
Aproximadament amb aquest mètode es van produir 96.000 tones l'any 1995.[2]
Reaccions àcid-base[modifica]
L'àcid sulfàmic és moderadament un àcid fort, Ka = 1.01 x 10−1. Com que el sòlid no és higroscòpic, es fa servir com a estàndard en acidimetria.
- H₃NSO₃ + NaOH → NaH₂NSO₃ + H₂O
Aplicacions[modifica]
L'àcid sulfàmic és el principal precursor de compostos de gust dolç. la reacció amb ciclohexilamina seguida de l'addició de l'NaOH dona C₆H11NHSO₃Na, ciclamat de sodi. Altres compostos relacionats són també edulcorants, com el potassi acesulfam.
Els sulfamats tenen ús en molts tipus d'agents terapèutics com antibiòtics, nucleòsid/nucleòtid, etc.[3]
Agent de neteja[modifica]
És usat com a agent àcid de neteja típicament per a metalls i ceràmica,[4] o detergents per treure la capa de calç. Comparat amb altres agents de neteja és poc volàtil i poc tòxic. Forma sals solubles en aigua de calci i de ferro fèrric.
Altres usos[modifica]
- catalitzador per al procés d'esterificació
- En la fabricació de tints i pigments
- Herbicida
- Coagulant per a resines d'urea-formaldehid
- Ingredient en retardants del foc..
- Estabilitzador del clorur en la indústria del paper
- Síntesi d'òxid nitrós per reacció amb àcid nítric
Referències[modifica]
- ↑ Yoshikubo, K.; Suzuki, M. «Sulfamic Acid and Sulfamates». A: Kirk-Othmer Encyclopedia of Chemical Technology, 2000. DOI 10.1002/0471238961.1921120625151908.a01. ISBN 0471238961.
- ↑ A. Metzger "Sulfamic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wily-VCH, Weinheim. doi:10.1002/14356007.a25_439
- ↑ Winum, J. Y.; Scozzafava, A.; Montero, J. L.; Supuran, C. T. «Sulfamates and their therapeutic potential». Medicinal Research Reviews, 25, 2, 2005, pàg. 186–228. DOI: 10.1002/med.20021. PMID: 15478125.
- ↑ Benckiser, Reckitt. «Material Safety Data Sheet - Lime-A-Way Lime, Calcium and Rust Cleaner (Trigger Spray)». hardwarestore.com. Arxivat de l'original el 28 de setembre 2011. [Consulta: 17 novembre 2011].
Enllaços externs[modifica]
- «Chemical Sampling Information - Sulfamic Acid». Occupational Health & Safety Administration, 06-05-1997. Arxivat de l'original el 29 de maig 2010. [Consulta: 17 novembre 2011].
- Cremlyn, R.J.. An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons, 1996. ISBN 978-0-471-95512-2.
- Greenwood, Norman N.; Earnshaw, A.. Chemistry of the Elements. 2a edició. Oxford: Butterworth-Heinemann, 1997, p. . ISBN 0-7506-3365-4.
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Àcid sulfàmic |
