Química de coordinació: diferència entre les revisions
Cap resum de modificació |
Cap resum de modificació |
||
| Línia 10: | Línia 10: | ||
==Camps de aplicació== |
==Camps de aplicació== |
||
La química de coordinació és important per les |
La química de coordinació és important per les seues aplicacions industrials (per exemple, en [[catàlisi]]), un altre camp d'aplicació d'interés és la [[química bioinorgànica]], que estudia les interaccions entre els [[Ió (àtom)|ions]] metàl·lics i les [[biomolècula|biomolècules]] com, per exemple, les [[metal·loproteïna|metal·loproteïnes]], [[enzim|enzims]] on en el [[centre actiu]] s'hi pot trobar com a mínim un metall coordinat pels [[aminoàcids]] de la [[proteïna]]. |
||
==Nomenclatura dels complexos== |
==Nomenclatura dels complexos== |
||
Revisió del 19:01, 10 oct 2011
La química de coordinació és la part de la química que estudia la síntesi, propietats i reactivitat dels complexos de coordinació, formats per un àtom o ió central i uns lligands als seu voltant.
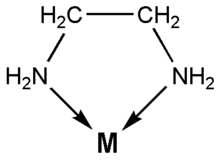
Dins la química de coordinació distinguim la química dels elements representatius (que tot i que no és habitual trobar-los coordinats, poden estar-ho), la química dels metalls de transició i la química dels lantànids i els actínids.
Principis
Els àtoms centrals són normalment metàl·lics (generalment cations de metalls de transició). El lligand ha de tenir, com a mínim, un parell d'electrons no compartits per a fer l'enllaç amb un dels orbitals buits del metall. A l'àtom on està situat aquest parell se li anomena àtom donador. Els lligands són tant espècies orgàniques com inorgàniques, i generalment són molècules neutres o anions. Quan un lligand està unit al centre metàl·lic per més d'un àtom donador, s'anomena lliguand quelant.
Les principals teories utilitzades en l'estudi dels complexos de coordinació són la Regla dels 18 electrons, la teoria del camp cristal·lí (que considera la interacció metall-lligand bàsicament iònica) i la teoria del camp de lligands o d'orbitals moleculars (que considera la interacció metall-lligand bàsicament covalent).
Camps de aplicació
La química de coordinació és important per les seues aplicacions industrials (per exemple, en catàlisi), un altre camp d'aplicació d'interés és la química bioinorgànica, que estudia les interaccions entre els ions metàl·lics i les biomolècules com, per exemple, les metal·loproteïnes, enzims on en el centre actiu s'hi pot trobar com a mínim un metall coordinat pels aminoàcids de la proteïna.
Nomenclatura dels complexos
Per anomenar un complex de coordinació se segueix el següent ordre
- S'anomenen tots els lligands ordenats per ordre alfàbetic. Quan un lligand estigui repetit s'ha d'escriure el prefix grec necessari (di-, tri-, tetra-,...), aquest prefix no es té en compte a l'hora d'ordenar alfabèticament. El nom dels lligans neutres és, en general, igual al de la molècula. El nom dels lligands aniònics és, en general, el nom de l'anió seguit d'una "o".
- A continuació es posa el nom del metall. Sí el complex té una càrrega total negativa, s'ha d'afegir el sufix "at".
- Finalment es posa entre parèntesi i en números romans l'estat d'oxidació.
