Nitrit de sodi
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 68,982673 Da |
| Rol | medicament essencial |
| Estructura química | |
| Fórmula química | NaNO₂ |
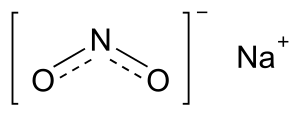 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Cristal·lografia | |
| Sistema cristal·lí | sistema ortoròmbic |
| Perill | |
| Regulació europea de productes químics (GHS02: inflamable, GHS06: calavera i tíbies, GHS09: medi ambient) NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Identificador Kemler | 56 |
El nitrit de sodi (antigament nitrit sòdic) és un compost utilitzat com a conservant en carns i peix, com additiu alimentari i en medicina. A la Unió Europea, el seu Codi E és el 250.
Preparació i conservació[modifica]
Preparació al laboratori[modifica]
El nitrit de sodi es pot preparar al laboratori reduint el nitrat de sodi amb plom.
Es fon el nitrat de sodi i s'afegeix, a poc a poc, el plom trossejat, tot remenant i barrejant-ho. Quan es refreda s'aboca el producte en una càpsula. Es renta el producte amb uns 200 ml d'aigua calenta i es repeteix el rentat però amb menys aigua. Per eliminar el plom es fa passar un corrent de diòxid de carboni, que el fa precipitar. Es filtra, es neutralitza amb àcid nítric i es concentra. Els cristalls obtinguts es renten amb aigua freda o etanol fred i s'evaporen a sequedat les aigües mare. El residu es fon, es deixa refredar en un dessecador i es guarda en un envàs hermèticament aïllat.
Conservació[modifica]
El nitrit de sodi s'ha de conservar en envàs completament aïllat, ja que l'oxigen de l'aire pot oxidar el nitrit a nitrat.
Usos[modifica]
Alimentació[modifica]
El nitrit de sodi s'utilitza com a conservant (E-250) en la indústria alimentària.
Medicina[modifica]
Recentment, s'ha trobat en el nitrit de sodi un mitjà per augmentar el flux de sang en dilatar els vasos sanguinis, ja que actua com a vasodilatador. S'està investigant per determinar la seva utilitat en tractaments per l'anèmia de cèl·lules falciformes, la intoxicació per cianur, atacs al cor, els aneurismes cerebrals, i la hipertensió pulmonar en els nens.
El nitrit de sodi es fa servir junt amb el tiosulfat de sodi quan es tracta l'enverinament per cianur.[1]
Additiu alimentari[modifica]
A principi del segle XX el curat dels aliments era irregular i això va portar a investigar l'acció del nitrit de sodi en els aliments.[2] Per aquesta recerca es va saber que el nitrit de sodi inhibia el creixement dels microorganismes indesitjables i dona gust i color a la carn; i inhibia l'oxidació dels lípids que provoca l'enranciment.[2][2] El seu Codi E és E250. El nitrit de potassi (E249) es fa servir de la mateixa manera. El seu ús està aprovat en la UE,[3][4] USA[5] i Austràlia i Nova Zelanda.[6]
Inhibició del creixement microbià[modifica]
El nitrit de sodi inhibeix el creixement de les espores de Clostridium botulinum en les carns refrigerades.[7]
Referències[modifica]
- ↑ WHO Model Formulary 2008. World Health Organization, 2009, p. 65-66. ISBN 9789241547659 [Consulta: 8 gener 2017].
- ↑ 2,0 2,1 2,2 Sindelar, Jeffrey; Milkowski, Andrew «Human safety controversies surrounding nitrate and nitrite in the diet». Nitric Oxide, 26, març 2012, pàg. 259–266. DOI: 10.1016/j.niox.2012.03.011.
- ↑ UK Food Standards Agency: «Current EU approved additives and their E Numbers». [Consulta: 27 octubre 2011].
- ↑ http://ec.europa.eu/food/fs/sc/scf/reports/scf_reports_38.pdf
- ↑ US Food and Drug Administration: «Listing of Food Additives Status Part II». [Consulta: 27 octubre 2011].
- ↑ Australia New Zealand Food Standards Code«Standard 1.2.4 – Labelling of ingredients». [Consulta: 27 octubre 2011].
- ↑ Milkowski, Andrew; Garg, Harsha; Couglin, James; Bryan, Nathan «Nutritional epidemiology in the context of nitric oxide biology: Risk-Benefit evaluation for dietary nitrite and nitrate». Nitric Oxide, 22, 2, gener 2010, pàg. 110–119. DOI: 10.1016/j.niox.2009.08.004. PMID: 19748594.
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Nitrit de sodi |
