Trasplantament de medul·la òssia
El trasplantament de medul·la òssia o el trasplantament de cèl·lules mare hematopoètiques és un procediment mitjançant el qual s'intercanvia o trasplanta la medul·la òssia d'un pacient per una medul·la òssia nova, ja sigui provinent del mateix pacient (trasplantament autòleg) o d'una altra persona (trasplantament al·logènic).[1][2][3] Aquest trasplantament continua sent un procediment de risc amb moltes possibles complicacions; tradicionalment s'ha reservat per a pacients que pateixen malalties que amenacen la seva vida.[4][5]
A tot el món l'any 2006 es van fer 50.417 trasplantaments d'aquest tipus. D'aquests 2.515 van ser autotrasplantaments i 21.516 al·logènics (de donants que eren familiars o d'altres donants). Les principals indicacions per aquests trasplantaments van ser malalties limfoproliferatives (54,5%) i leucèmia (33,8%).[6]
Història
[modifica]Georges Mathé, un oncòleg francès, va realitzar el primer trasplantament de medul·la òssia l'any 1959 en cinc treballadors iugoslaus irradiats en un accident però tots aquests trasplantaments van ser rebutjats pels cossos dels trasplantats.[7][8][9][10][11]
El primer metge a fer aquest trasplantament amb èxit en una malaltia no cancerosa va ser Robert A. Good el 1968.
A Catalunya i a tot l'Estat espanyol, el primer trasplantament de medul·la òssia va tenir lloc el 22 de maig de 1976 a l'Hospital de la Santa Creu i Sant Pau per part dels hematòlegs Andreu Domingo Albós i Josep Cubells. La pacient va ser una jove catalana de 13 anys amb leucèmia.[12]
Tipus d'empelt
[modifica]Autoempelt
[modifica]Aquest tipus que també s'anomena autòleg, requereix l'extracció de cèl·lules mare hematopoètiques (HSC) del mateix pacient i emmagatzemar aquestes cèl·lules en un congelador. Aleshores el pacient és tractat amb quimioteràpia per erradicar les cèl·lules malignes. Les cèl·lules emmagatzemades es tornen a introduir en el pacient. Els trasplantaments autòlegs tenen l'avantatge d'un menor risc d'infecció durant la fase immunocompromesa del tractament, ja que la recuperació de la funció immunitària és ràpida. A més són rars els rebuigs, ja que donant i receptor són el mateix individu. Aquests avantatges han fet l'autòleg com un dels estàndards per a tractaments de malalties com el limfoma.[13] Tanmateix per altres condicions es prefereix el tractament al·logènic.[14]
Al·logènic
[modifica]El tractament al·logènic implica dues persones: el donant (saludable) i el receptor (pacient). Els donants al·logènics han de tenir un tipus de teixit (HLA) que coincideixi amb el destinatari. La coincidència es realitza sobre la base de la variabilitat en tres o més loci del gen HLA, i es prefereix en aquests loci una parella ideal. Fins i tot si hi ha una bona coincidència en aquests al·lels crítics, el destinatari serà necessari que rebi medicaments immunosupressors per mitigar la malaltia de l'empelt contra l'hoste. Els donants de trasplantament al·logènic poden estar relacionats (en general un germà HLA compatible de prop), singènic (uns bessons monozigòtics o "idèntics" del pacient - cosa necessàriament molt rara, ja que pocs pacients tenen un bessó idèntic, però que ofereix una font de cèl·lules mare perfectament compatible per HLA) o no relacionades (un donant que no està relacionat i es va trobar que tenen un grau molt a prop de la compatibilitat HLA). Els donants no relacionats es poden trobar a través d'un registre de donants de medul·la òssia.[15]
La raça humana i l'etnicitat se sap que té un paper molt gran en el reclutament de donants, ja que els membres del mateix grup ètnic és més probable que tinguin gens coincidents, incloent els gens per HLA.[16]
Fonts i emmagatzematge de cèl·lules
[modifica]Per limitar el risc de rebuig de les cèl·lules mare trasplantades o una malaltia severa d'empelt contra hoste en el trasplantament al·logènic, el donant hauria de tenir el mateixos antígens leucòcits humans que el receptor. Un 25% dels receptors al·logènics tenen una coincidència perfecta però fins i tot en aquest cas poden tenir al·lels menors no coincidents que contribueixin a la malaltia d'empelt contra hoste.
Medul·la òssia
[modifica]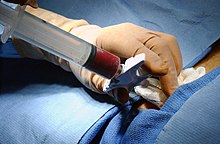
En el cas del trasplantament de medul·la òssia el HSC es treu d'un os gros del donant, típicament la pelvis, amb una llarga agulla hipodèrmica que arriba al centre de l'os. Aquesta tècnica es fa amb anestèsia general.
Cèl·lules mare de la sang perifèriques
[modifica]Les cèl·lules mare de la sang perièriques[17] són actualment la font més comuna de cèl·lules mare pel HSCT al·logènic. Es recullen de la sang pel procés d'afèresi. Es treuen leucòcits del donant i es retornen els seus glòbuls rojos.
Fluid amniòtic
[modifica]També és possible extreure cèl·lules mare hematopoètiques del fluid amniòtic fen el moment del naixement dels nadons.
Sang del cordó umbilical
[modifica]La sang de cordó umbilical s'obté quan una mare dona el cordó umbilical i la placenta del seu nadó després del naixement. La sang del cordó umbilical té una concentració més alta de HSC que la sang normal d'un adult. Tanmateix, la petita quantitat de sang obtinguda d'un cordó umbilical (uns 50 ml) la fan més adequada per trasplantament en nens petits que no pas per adults si no s'apliquen unes noves tècniques addicionals.
Emmagatzematge de HSC
[modifica]Al contrari que en altres òrgans, les cèl·lules de la medul·la òssia es poden congelar (crioconservació) per períodes perllongats, sense danys. Això cal en cas del HSC autòleg, ja que les cèl·lules es recullen mesos abans del trasplantament. En el cas dels trasplantaments al·logènics es prefereixen les cèl·lules fresques.
Referències
[modifica]- ↑ Trasplante de médula ósea en MedlinePlus
- ↑ Trasplante de médula ósea: una apuesta tan arriesgada como milagrosa, Soitu, 22/02/2009
- ↑ Alteraciones metabólicas y nutricionales en pacientes con trasplante de médula ósea, Metabolismo, nutrición y shock, Patiño Restrepo, J.F., 4ªed. edi. panamericana, 2006, Colombia
- ↑ Tyndall A, Fassas A, Passweg J, et al. «Autologous haematopoietic stem cell transplants for autoimmune disease--feasibility and transplant-related mortality. Autoimmune Disease and Lymphoma Working Parties of the European Group for Blood and Marrow Transplantation, the European League Against Rheumatism and the International Stem Cell Project for Autoimmune Disease». Bone Marrow Transplant., 24, 7, 1999, pàg. 729–34. DOI: 10.1038/sj.bmt.1701987. PMID: 10516675.
- ↑ Burt RK, Loh Y, Pearce W, et al. «Clinical applications of blood-derived and marrow-derived stem cells for nonmalignant diseases». JAMA, 299, 8, 2008, pàg. 925–36. DOI: 10.1001/jama.299.8.925. PMID: 18314435.
- ↑ Gratwohl A, Baldomero H, Aljurf M, et al. «Hematopoietic stem cell transplantation: a global perspective.». JAMA, 303, 16, 2010, pàg. 1617–24. DOI: 10.1001/jama.2010.491. PMID: 20424252.
- ↑ McLaughlin et al. page 96, "Radiation doses were intense, being estimated at 205, 320, 410, 415, 422, and 433 rem.74 Of the six persons present, one died and the other five recovered after severe cases of radiation sickness."
- ↑ «1958-01-01». [Consulta: 2 gener 2011].
- ↑ Vinca reactor accident, 1958, compiled by Wm. Robert Johnston
- ↑ Nuove esplosioni a Fukushima: danni al nocciolo. Ue: “In Giappone l'apocalisse”, 14 marzo 2011
- ↑ Martin, Douglas «Dr. Georges Mathé, Transplant Pioneer, Dies at 88». New York Times, 20-10-2010.
- ↑ «40 anys trasplantant» (en català). El Periódico, 14-02-2018. [Consulta: 1r febrer 2024].
- ↑ Canellos, George «The Role of Salvage Therapy in Malignant Lymphomas». The Oncologist, 2, 3, 1997, pàg. 181–183.
- ↑ Bruno B, Rotta M, Patriarca F, et al. «A comparison of allografting with autografting for newly diagnosed myeloma». N. Engl. J. Med., 356, 11, 2007, pàg. 1110–20. DOI: 10.1056/NEJMoa065464. PMID: 17360989.
- ↑ "Getting Tested: Bone Marrow Donor Options"
- ↑ «Còpia arxivada». Arxivat de l'original el 2008-08-07. [Consulta: 7 febrer 2012].
- ↑ Cutler C, Antin JH «Peripheral blood stem cells for allogeneic transplantation: a review». Stem Cells, 19, 2, 2001, pàg. 108–17. DOI: 10.1634/stemcells.19-2-108. PMID: 11239165.
