Fosfolipasa C: diferència entre les revisions
| Línia 1: | Línia 1: | ||
== Introducció == |
|||
{{Infotaula compost químic}} |
{{Infotaula compost químic}} |
||
La '''Fosfolipasa C''' és una classe d'enzims de senyalització transmembrana que catalitza la conversió de 1-fosfatidil-1D-mio-inositol 4,5-bisfosfat ([[PIP2]]) a 1D-mio-inositol 1,4,5-trisfosfat ([[IP3]]) i [[Diglicèrid|diacilglicerol]] (DAG) utilitzant el calci com a [[Cofactor enzimàtic|cofactor]]. Aquests segons missatgers regulen posteriorment diversos processos que afecten el creixement, la diferenciació i l'expressió gènica de les cèl·lules com la via de senyalització de la PKC |
La '''Fosfolipasa C''' és una classe d'enzims de senyalització transmembrana que catalitza la conversió de 1-fosfatidil-1D-mio-inositol 4,5-bisfosfat ([[PIP2]]) a 1D-mio-inositol 1,4,5-trisfosfat ([[IP3]]) i [[Diglicèrid|diacilglicerol]] (DAG) utilitzant el calci com a [[Cofactor enzimàtic|cofactor]]. Aquests segons missatgers regulen posteriorment diversos processos que afecten el creixement, la diferenciació i l'expressió gènica de les cèl·lules com la via de senyalització de la PKC. El procés és el següent:[[Fitxer:Fosfolipasa_C_(2).jpg|enllaç=https://ca.wikipedia.org/wiki/Fitxer:Fosfolipasa_C_(2).jpg|miniatura|500x500px|Passos de la PKC: exemple d'una via de senyalització cel·lular]] |
||
| ⚫ | |||
| ⚫ | |||
[[Fitxer:Fosfolipasa_C_(2).jpg|enllaç=https://ca.wikipedia.org/wiki/Fitxer:Fosfolipasa_C_(2).jpg|miniatura|500x500px|Passos de la PKC: exemple d'una via de senyalització cel·lular]] |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
La fosfolipasa C, tot i no ser un dels fosfolípids més abundants en les membranes cel·lulars com són la [[fosfatidilcolina]], [[fosfatidiletanolamina]], [[fosfaditilserina]] i [[esfingomielina]], és considerat un [[fosfolípid]] fonamental per a la regulació de funcions cel·lulars. Situada al nivell de monocapa interna citosòlica, normalment en estat inert, pot experimentar transformacions sota l'acció de quinases. |
La fosfolipasa C, tot i no ser un dels fosfolípids més abundants en les membranes cel·lulars com són la [[fosfatidilcolina]], [[fosfatidiletanolamina]], [[fosfaditilserina]] i [[esfingomielina]], és considerat un [[fosfolípid]] fonamental per a la regulació de funcions cel·lulars. Situada al nivell de monocapa interna citosòlica, normalment en estat inert, pot experimentar transformacions sota l'acció de quinases. |
||
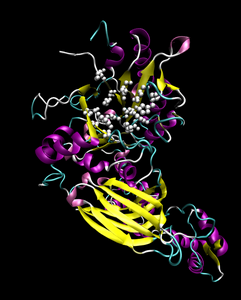
[[Fitxer:PDB 1ah7 EBI.jpg|miniatura|Estructura de la fosfolipasa.]] |
|||
Podem trobar un total de 13 tipus de PLC en els mamífers, que es classifiquen en sis isotips:β,𝝳,ɣ,ε,𝜁,η. Les PLC tenen un paper important en la fisiologia de les cèl·lules eucariotes, concretament en les vies de transducció de senyals. |
Podem trobar un total de 13 tipus de PLC en els mamífers, que es classifiquen en sis isotips:β,𝝳,ɣ,ε,𝜁,η. Les PLC tenen un paper important en la fisiologia de les cèl·lules eucariotes, concretament en les vies de transducció de senyals. |
||
| Línia 31: | Línia 21: | ||
== Tipus de Fosfolipasa C == |
== Tipus de Fosfolipasa C == |
||
| ⚫ | |||
PLCβ,𝝳,ɣ,ε,𝜁,η: Es troba en el subdomini el subdomini homològic pleckstrin terminal-N. |
|||
En la majoria d'elles, la connectivitat de senyalització segueix molt lligada a la proteïna-G. <ref>{{Ref-publicació|article=Phospholipase C families: Common themes and versatility in physiology and pathology|url=http://www.sciencedirect.com/science/article/pii/S016378272030045X|publicació=Progress in Lipid Research|data=2020-11-01|issn=0163-7827|pàgines=101065|volum=80|doi=10.1016/j.plipres.2020.101065|llengua=en|nom=Matilda|cognom=Katan|nom2=Shamshad|cognom2=Cockcroft}}</ref> |
|||
| ⚫ | |||
En la majoria d'elles, la connectivitat de senyalització segueix molt lligada a la proteïna-G. |
|||
=== Fosfolipasa β (PLC β) === |
=== Fosfolipasa β (PLC β) === |
||
Les proteïnes per aquesta família inclouen Galfa i Gbetagamma com també petites GTPases. Veure estructura a fons, ja que és aquesta la que defineix les regions específiques en l’autoinhibició i les interaccions amb proteïnes de regulació específiques. Té un important rol en el sistema cardiovascular, on el seu desfassament pot provocar hipertrofia. |
Les proteïnes per aquesta família inclouen Galfa i Gbetagamma com també petites GTPases. Veure estructura a fons, ja que és aquesta la que defineix les regions específiques en l’autoinhibició i les interaccions amb proteïnes de regulació específiques. Té un important rol en el sistema cardiovascular, on el seu desfassament pot provocar hipertrofia. |
||
* '''PCLB1 (Beta 1):''' S’expressa en molts llocs i en alts nivells al cortex cerebral i a l’hipocamp. S’enllaça amb els “muscarinic cholineric receptors” (ratolins). Patologia (humans) causada per l’eliminació de “homozygous”: Activat per Gαq/11 |
* '''PCLB1 (Beta 1):''' S’expressa en molts llocs i en alts nivells al cortex cerebral i a l’hipocamp. S’enllaça amb els “muscarinic cholineric receptors” (ratolins). Patologia (humans) causada per l’eliminació de “homozygous”: Activat per Gαq/11. <ref>{{Ref-web|títol=Homo sapiens PLCB1 - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/?term=Homo+sapiens+PLCB1|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCB1 Gene - GeneCards {{!}} PLCB1 Protein {{!}} PLCB1 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCB1&keywords=PLCB1|llengua=|editor=|data=}}</ref> |
||
* '''PCLB2 (Beta 2):''' Expressió limitada a cèl·lules bronquials epitelials. La seva transducció es basa en que el Ca2+ estimula l’entrada dels canals TRPM5. Activat per Rac. |
* '''PCLB2 (Beta 2):''' Expressió limitada a cèl·lules bronquials epitelials. La seva transducció es basa en que el Ca2+ estimula l’entrada dels canals TRPM5. Activat per Rac.<ref>{{Ref-web|títol=PLCB2 phospholipase C beta 2 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/5330|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCB2 Gene - GeneCards {{!}} PLCB2 Protein {{!}} PLCB2 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCB2&keywords=PLCB2|llengua=|editor=|data=}}</ref> |
||
* '''PCLB3 (Beta 3):''' Activitat de la PLC no requerida per “myeloproliferative diesease”. Activat per rac. |
* '''PCLB3 (Beta 3):''' Activitat de la PLC no requerida per “myeloproliferative diesease”. Activat per rac.<ref>{{Ref-web|títol=PLCB3 phospholipase C beta 3 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/5331|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCB3 Gene - GeneCards {{!}} PLCB3 Protein {{!}} PLCB3 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCB3&keywords=PLCB2|llengua=|editor=|data=}}</ref> |
||
* '''PCLB4 (Beta 4):''' Molt expressada al cerebel i s’adapta al receptor metabotròpic de glutamat. |
* '''PCLB4 (Beta 4):''' Molt expressada al cerebel i s’adapta al receptor metabotròpic de glutamat.<ref>{{Ref-web|títol=PLCB4 phospholipase C beta 4 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/5332|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCB4 Gene - GeneCards {{!}} PLCB4 Protein {{!}} PLCB4 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCB4&keywords=PLCB2|llengua=|editor=|data=}}</ref> |
||
=== Fosfolipasa 𝝳 (PLC 𝝳) === |
=== Fosfolipasa 𝝳 (PLC 𝝳) === |
||
Activador poc conegut. Hidrolitza l’enllaç fosfodièster distal dels fosfolípids. Mitjançant aquesta reacció, la PCL𝝳 allibera el grup de capçal del substrat fosfolípid i produeix PA. També catalitza la reacció de transfosfatidilació, que consisteix en l’intercanvi del grup de capçalera del substrat fosfolípid a un altre grup de capçalera, produint així un nou fosfolípid. |
Activador poc conegut. Hidrolitza l’enllaç fosfodièster distal dels fosfolípids. Mitjançant aquesta reacció, la PCL𝝳 allibera el grup de capçal del substrat fosfolípid i produeix PA. També catalitza la reacció de transfosfatidilació, que consisteix en l’intercanvi del grup de capçalera del substrat fosfolípid a un altre grup de capçalera, produint així un nou fosfolípid. |
||
* '''PCLD1 (Delta 1):''' Produeix molècules missatgeres diacilglicerol i inositol 1,4,5-trifosfat. És essencial per al desenvolupament de la placenta i dels trofoblasts.<ref>{{Ref-web|títol=PLCD1 phospholipase C delta 1 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/5333|llengua=|editor=|data=}}</ref><ref name=":0">{{Ref-publicació|article=Phospholipases: An Overview|cognom=Aloulou|nom5=Abdelkarim|cognom4=Noiriel|nom4=Alexandre|cognom3=Arhab|nom3=Yani|cognom2=Rahier|nom2=Renaud|nom=Ahmed|url=https://pubmed.ncbi.nlm.nih.gov/30109646/|doi=10.1007/978-1-4939-8672-9_3|volum=1835|pàgines=69–105|pmid=30109646|issn=1940-6029|data=2018|publicació=Methods in Molecular Biology (Clifton, N.J.)|cognom5=Abousalham}}</ref><ref>{{Ref-web|títol=PLCD1 Gene - GeneCards {{!}} PLCD1 Protein {{!}} PLCD1 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCD1&keywords=PLCD1|llengua=|editor=|data=}}</ref> |
|||
* '''PCLD1 (Delta 1):''' Produeix molècules missatgeres diacilglicerol i inositol 1,4,5-trifosfat. És essencial per al desenvolupament de la placenta i dels trofoblastos. |
|||
* '''PCLD2 (Delta 2):''' Situat a la membrana plasmàtica i s’ha informat que participa en el tràfic de membranes i en nombroses vies de senyalització |
* '''PCLD2 (Delta 2):''' Situat a la membrana plasmàtica i s’ha informat que participa en el tràfic de membranes i en nombroses vies de senyalització |
||
* '''PCLD3 (Delta 3):''' Imprescindible per al desenvolupament del trofoblast i de la placenta. Pot participar en la citocinesi hidrolitzant PIP2 al solc de trencament. [ |
* '''PCLD3 (Delta 3):''' Imprescindible per al desenvolupament del trofoblast i de la placenta. Pot participar en la citocinesi hidrolitzant PIP2 al solc de trencament.<ref>{{Ref-web|títol=PLCD3 Gene - GeneCards {{!}} PLCD3 Protein {{!}} PLCD3 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCD3|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCD3 phospholipase C delta 3 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/113026|llengua=|editor=|data=}}</ref><ref name=":0" /> |
||
* '''PCLD4 (Delta 4 i):''' Es requereix per a la reacció d’acrosomes a l’esperma durant la fecundació, probablement actuant com un enzim important per a la mobilització intracel·lular de Ca2+ a la reacció d’acrosoma induïda per la zona pellucida. Pot tenir un paper en el creixement cel·lular. Modula la regeneració hepàtica en cooperació amb PKC nuclear. La sobreexpressió regula la via de senyalització i proliferació d’Erk [ |
* '''PCLD4 (Delta 4 i):''' Es requereix per a la reacció d’acrosomes a l’esperma durant la fecundació, probablement actuant com un enzim important per a la mobilització intracel·lular de Ca2+ a la reacció d’acrosoma induïda per la zona pellucida. Pot tenir un paper en el creixement cel·lular. Modula la regeneració hepàtica en cooperació amb PKC nuclear. La sobreexpressió regula la via de senyalització i proliferació d’Erk.<ref>{{Ref-web|títol=PLCD4 Gene - GeneCards {{!}} PLCD4 Protein {{!}} PLCD4 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCD4|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCD4 phospholipase C delta 4 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/84812|llengua=|editor=|data=}}</ref> |
||
* '''PCLD5 (Delta 5):''' Presenta un domini transmembrana però fins ara no s’ha caracteritzat. A més, aquesta isoforma presenta substitucions no conservadores al seu lloc actiu. |
* '''PCLD5 (Delta 5):''' Presenta un domini transmembrana però fins ara no s’ha caracteritzat. A més, aquesta isoforma presenta substitucions no conservadores al seu lloc actiu. <ref name=":0" /> |
||
* '''PCLD6 (Delta 6):''' Involucrada en la biogènesi dels RNAs que interactuen amb Piwi (piRNAs). |
* '''PCLD6 (Delta 6):''' Involucrada en la biogènesi dels RNAs que interactuen amb Piwi (piRNAs). <ref name=":0" /> |
||
=== Fosfolipasa ɣ (PLC ɣ) === |
=== Fosfolipasa ɣ (PLC ɣ) === |
||
Alta expressió a la [[medul·la òssia]]. Regula el desenvolupament i la funció de les cèl·lules hematopoètiques. Activats per la fosforilació de ''varios tirosina quinases receptores i no receptor''. N'hi ha dos tipus, la PLCG1 i la PLCG2 |
Alta expressió a la [[medul·la òssia]]. Regula el desenvolupament i la funció de les cèl·lules hematopoètiques. Activats per la fosforilació de ''varios tirosina quinases receptores i no receptor''. N'hi ha dos tipus, la PLCG1 i la PLCG2. <ref name=":0" /> |
||
* '''PLCG1 (Gamma 1):''' S'utilitza per desenvolupar drogues en contra del càncer. <ref>{{Ref-web|títol=PLCG1 phospholipase C gamma 1 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/5335|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCG1 Gene - GeneCards {{!}} PLCG1 Protein {{!}} PLCG1 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCG1&keywords=PLCG1|llengua=|editor=|data=}}</ref> |
|||
* '''PLCG1 (Gamma 1):''' S'utilitza per desenvolupar drogues en contra del càncer. |
|||
* '''PLCG2 (Gamma 2):''' És un efector crític de senyalització del receptor de cèl·lules pre-B (BCR), que és fonamental per al desenvolupament i la maduració de les cèl·lules B. (5). Activat per Rac. |
* '''PLCG2 (Gamma 2):''' És un efector crític de senyalització del receptor de cèl·lules pre-B (BCR), que és fonamental per al desenvolupament i la maduració de les cèl·lules B. (5). Activat per Rac. <ref>{{Ref-web|títol=PLCG2 phospholipase C gamma 2 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/5336|llengua=|editor=|data=}}</ref><ref>{{Ref-web|títol=PLCG2 Gene - GeneCards {{!}} PLCG2 Protein {{!}} PLCG2 Antibody|url=https://www.genecards.org/cgi-bin/carddisp.pl?gene=PLCG2&keywords=PLCG2|llengua=|editor=|data=}}</ref> |
||
[[Fitxer:1-s2.0-S016378272030045X-gr2 lrg.jpg|miniatura|380x380px|Esquema dels dominis dels diferents tipus de Fosfolipasa C]] |
|||
* |
* |
||
=== Fosfolipasa ε (PLC ε) === |
=== Fosfolipasa ε (PLC ε) === |
||
Alta expressió al cor. Regula el desenvolupament i les funcions dels cardiomiòcits. Activat per GTPases: Ras, Rap, Rho |
Alta expressió al cor. Regula el desenvolupament i les funcions dels cardiomiòcits. Activat per GTPases: Ras, Rap, Rho. |
||
* '''PLCE1 (Epsilon 1):''' PLCε es troba a la zona perinuclear i hidrolitza el substrat no canònic PI4P a l'aparell perinuclear de Golgi per generar DAG als cardiomiòcits. Aleshores, DAG activa la proteïna quinasa hipertròfica quinasa D (PKD). |
* '''PLCE1 (Epsilon 1):''' PLCε es troba a la zona perinuclear i hidrolitza el substrat no canònic PI4P a l'aparell perinuclear de Golgi per generar DAG als cardiomiòcits. Aleshores, DAG activa la proteïna quinasa hipertròfica quinasa D (PKD).<ref>{{Ref-web|títol=PLCE1 phospholipase C epsilon 1 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/51196|llengua=|editor=|data=}}</ref> |
||
=== Fosfolipasa 𝜁 (PLC 𝜁) === |
=== Fosfolipasa 𝜁 (PLC 𝜁) === |
||
Expressió específica en espermatozoides, el PLCζ té un paper crucial en la fecundació. PLCζ és la molècula clau derivada de l'esperma que indueix l'oscil·lació de Ca2 +, que és fonamental per a l'activació dels òvuls, durant la fecundació. Activador poc conegut. |
Expressió específica en espermatozoides, el PLCζ té un paper crucial en la fecundació. PLCζ és la molècula clau derivada de l'esperma que indueix l'oscil·lació de Ca2 +, que és fonamental per a l'activació dels òvuls, durant la fecundació. Activador poc conegut. |
||
* '''PLC𝜁1 (zeta 1):''' Es localitza a l'acrosoma dels espermatozoides |
* '''PLC𝜁1 (zeta 1):''' Es localitza a l'acrosoma dels espermatozoides <ref>{{Ref-web|títol=PLCZ1 phospholipase C zeta 1 [Homo sapiens (human)] - Gene - NCBI|url=https://www.ncbi.nlm.nih.gov/gene/89869|llengua=|editor=|data=}}</ref> |
||
=== Fosfolipasa η (PLC η) === |
=== Fosfolipasa η (PLC η) === |
||
| Línia 102: | Línia 88: | ||
[[Fitxer:Taula 2.png|esquerra|miniatura|387x387px|PLCβ4, PLCγ1, PLCγ2]][[Fitxer:Taula 4.png|miniatura|417x417px|PLCε, PLCPη1, PLCη2]] |
[[Fitxer:Taula 2.png|esquerra|miniatura|387x387px|PLCβ4, PLCγ1, PLCγ2]][[Fitxer:Taula 4.png|miniatura|417x417px|PLCε, PLCPη1, PLCη2]] |
||
| Línia 135: | Línia 103: | ||
== Estructura == |
== Estructura == |
||
L'estructura d eles fosfolipases és particular per a cada tipus [[Isoenzim|isozim]]. Tot i així, té una estructura nuclear present en tots els isozims: |
L'estructura d eles fosfolipases és particular per a cada tipus [[Isoenzim|isozim]]. Tot i així, té una estructura nuclear present en tots els isozims: [[Fitxer:PDB 1ah7 EBI.jpg|miniatura|Estructura de la fosfolipasa.]] |
||
* '''Barril catalític α / β:''' S'encarrega de les funcions de [[Catàlisi enzimàtica|catàlisi]] de les fosfolipases. El barril catalític es forma a partir de les regions X (147 residus) i Y (118 residus). El domini està format per α-hèlixs i làmines β. S'assembla a una [[triosa fosfat isomerasa]] (TIM) incompleta. Els residus catalítics es troben en l'extrem del barril, que està parcialment vorejat per residus hidrofòbics. Està format per una cavitat poc profunda a l'extrem carboxi-terminal. La punta forma una estructura semblant a un broc que pot permetre l'entrada i sortida dels reactius o productes a la superfície de la membrana. La seqüència que uneix les meitats X i Y del barril (43 residus) està molt desordenada i no forma part integral de l'estructura, tot i que pot tenir una funció reguladora important. |
* '''Barril catalític α / β:''' S'encarrega de les funcions de [[Catàlisi enzimàtica|catàlisi]] de les fosfolipases. El barril catalític es forma a partir de les regions X (147 residus) i Y (118 residus). El domini està format per α-hèlixs i làmines β. S'assembla a una [[triosa fosfat isomerasa]] (TIM) incompleta. Els residus catalítics es troben en l'extrem del barril, que està parcialment vorejat per residus hidrofòbics. Està format per una cavitat poc profunda a l'extrem carboxi-terminal. La punta forma una estructura semblant a un broc que pot permetre l'entrada i sortida dels reactius o productes a la superfície de la membrana. La seqüència que uneix les meitats X i Y del barril (43 residus) està molt desordenada i no forma part integral de l'estructura, tot i que pot tenir una funció reguladora important. |
||
Revisió del 21:47, 8 nov 2020
 Fosfolipasa Cδ-1 | |
| Substància química | família d'enzims |
|---|---|
La Fosfolipasa C és una classe d'enzims de senyalització transmembrana que catalitza la conversió de 1-fosfatidil-1D-mio-inositol 4,5-bisfosfat (PIP2) a 1D-mio-inositol 1,4,5-trisfosfat (IP3) i diacilglicerol (DAG) utilitzant el calci com a cofactor. Aquests segons missatgers regulen posteriorment diversos processos que afecten el creixement, la diferenciació i l'expressió gènica de les cèl·lules com la via de senyalització de la PKC. El procés és el següent:

- Fixació de la molècula senyalitzadora sota el receptor acoplat a la proteïna G específica.
- Hidròlisi de la GTP
- Fosforilació i activació de la proteïna G
- Desplaçament de la proteïna G i activació de la PLC.
- Fixació de la IP3 a nivell de reticle endoplasmàtic llis i alliberació de Ca2+ com a segon missatger.
- Activació de la proteïna Kinasa C pel Ca2+ i el diacilglycerol (DAG)
- Fosforilació del canal iònic o de cert enzim específic per la proteïna-cinasa C.
- Resposta cel·lular en cascada.
La fosfolipasa C, tot i no ser un dels fosfolípids més abundants en les membranes cel·lulars com són la fosfatidilcolina, fosfatidiletanolamina, fosfaditilserina i esfingomielina, és considerat un fosfolípid fonamental per a la regulació de funcions cel·lulars. Situada al nivell de monocapa interna citosòlica, normalment en estat inert, pot experimentar transformacions sota l'acció de quinases. Podem trobar un total de 13 tipus de PLC en els mamífers, que es classifiquen en sis isotips:β,𝝳,ɣ,ε,𝜁,η. Les PLC tenen un paper important en la fisiologia de les cèl·lules eucariotes, concretament en les vies de transducció de senyals.
Història
La fosfolipasa C va ser observada per primer cop a l'estudi del metabolisme de fosfoinositides al 1979[1]. Es va observar per primera vegada que el metabolisme podia ser relacionat amb variacions de Ca2+ al citosol. Pocs anys després es va aconseguir purificar les primeres fosfolipases C[2] com també es va identificar l'IP3 com a segon missatger implicat en l'alliberament de calci al citosol provinent del reticle endoplasmàtic[3].
La PLC va patir un canvi de paradigma quan es van descobrir diferents isòmers de PLCs de diferents tamanys i diferents subdominis, PLC-I, PLC-II, PLC-III[4] com també es van trobar diferents tipus de PLC en diverses espècies. Anys després es varen batejar els diferents tipus de fosfolipases C segons l'alfabet grec[5] i se’n van descobrir tres tipus més: ε, ζ, η, que tot i fer la mateixa funció, s'activen de diferents maneres: mitjançant receptors acoblats a proteïnes G, ja sigui per receptors amb activitat de tirosina cinasa (RTK) o per Ca2 + intracel·lular.
Tipus de Fosfolipasa C

Totes elles menys la zeta comparteixen un nucli estructural a part d'una varietat de dominis específics per cada família, a part, quatre EF hand domains.
En la majoria d'elles, la connectivitat de senyalització segueix molt lligada a la proteïna-G. [6]
Fosfolipasa β (PLC β)
Les proteïnes per aquesta família inclouen Galfa i Gbetagamma com també petites GTPases. Veure estructura a fons, ja que és aquesta la que defineix les regions específiques en l’autoinhibició i les interaccions amb proteïnes de regulació específiques. Té un important rol en el sistema cardiovascular, on el seu desfassament pot provocar hipertrofia.
- PCLB1 (Beta 1): S’expressa en molts llocs i en alts nivells al cortex cerebral i a l’hipocamp. S’enllaça amb els “muscarinic cholineric receptors” (ratolins). Patologia (humans) causada per l’eliminació de “homozygous”: Activat per Gαq/11. [7][8]
- PCLB2 (Beta 2): Expressió limitada a cèl·lules bronquials epitelials. La seva transducció es basa en que el Ca2+ estimula l’entrada dels canals TRPM5. Activat per Rac.[9][10]
- PCLB3 (Beta 3): Activitat de la PLC no requerida per “myeloproliferative diesease”. Activat per rac.[11][12]
Fosfolipasa 𝝳 (PLC 𝝳)
Activador poc conegut. Hidrolitza l’enllaç fosfodièster distal dels fosfolípids. Mitjançant aquesta reacció, la PCL𝝳 allibera el grup de capçal del substrat fosfolípid i produeix PA. També catalitza la reacció de transfosfatidilació, que consisteix en l’intercanvi del grup de capçalera del substrat fosfolípid a un altre grup de capçalera, produint així un nou fosfolípid.
- PCLD1 (Delta 1): Produeix molècules missatgeres diacilglicerol i inositol 1,4,5-trifosfat. És essencial per al desenvolupament de la placenta i dels trofoblasts.[15][16][17]
- PCLD2 (Delta 2): Situat a la membrana plasmàtica i s’ha informat que participa en el tràfic de membranes i en nombroses vies de senyalització
- PCLD3 (Delta 3): Imprescindible per al desenvolupament del trofoblast i de la placenta. Pot participar en la citocinesi hidrolitzant PIP2 al solc de trencament.[18][19][16]
- PCLD4 (Delta 4 i): Es requereix per a la reacció d’acrosomes a l’esperma durant la fecundació, probablement actuant com un enzim important per a la mobilització intracel·lular de Ca2+ a la reacció d’acrosoma induïda per la zona pellucida. Pot tenir un paper en el creixement cel·lular. Modula la regeneració hepàtica en cooperació amb PKC nuclear. La sobreexpressió regula la via de senyalització i proliferació d’Erk.[20][21]
- PCLD5 (Delta 5): Presenta un domini transmembrana però fins ara no s’ha caracteritzat. A més, aquesta isoforma presenta substitucions no conservadores al seu lloc actiu. [16]
- PCLD6 (Delta 6): Involucrada en la biogènesi dels RNAs que interactuen amb Piwi (piRNAs). [16]
Fosfolipasa ɣ (PLC ɣ)
Alta expressió a la medul·la òssia. Regula el desenvolupament i la funció de les cèl·lules hematopoètiques. Activats per la fosforilació de varios tirosina quinases receptores i no receptor. N'hi ha dos tipus, la PLCG1 i la PLCG2. [16]
- PLCG1 (Gamma 1): S'utilitza per desenvolupar drogues en contra del càncer. [22][23]
- PLCG2 (Gamma 2): És un efector crític de senyalització del receptor de cèl·lules pre-B (BCR), que és fonamental per al desenvolupament i la maduració de les cèl·lules B. (5). Activat per Rac. [24][25]
Fosfolipasa ε (PLC ε)
Alta expressió al cor. Regula el desenvolupament i les funcions dels cardiomiòcits. Activat per GTPases: Ras, Rap, Rho.
- PLCE1 (Epsilon 1): PLCε es troba a la zona perinuclear i hidrolitza el substrat no canònic PI4P a l'aparell perinuclear de Golgi per generar DAG als cardiomiòcits. Aleshores, DAG activa la proteïna quinasa hipertròfica quinasa D (PKD).[26]
Fosfolipasa 𝜁 (PLC 𝜁)
Expressió específica en espermatozoides, el PLCζ té un paper crucial en la fecundació. PLCζ és la molècula clau derivada de l'esperma que indueix l'oscil·lació de Ca2 +, que és fonamental per a l'activació dels òvuls, durant la fecundació. Activador poc conegut.
- PLC𝜁1 (zeta 1): Es localitza a l'acrosoma dels espermatozoides [27]
Fosfolipasa η (PLC η)
- Directament activat per la proteïna Gβɣ. Conté un domini PH, EF tàndem, barril catalític alfa beta, motius C2. La regió d'enllaç està composta per una cadena d'aminoàcids 100aa’ més gran que la δ. Alta implicació en l'amplificació de senyals transitòries de Ca2+. Gran presència d'ambdós tipus al cerbell.
- PLCη1 (eta 1): Distribuït entre fraccions de membrana i citosòliques. Actua juntament amb la PLCβ per estimular l'activació de
- PLCη2 (eta 2): Poden modular l'exocitosi de partícules quan els nivells de Ca2+ són alts.Conté un domini PH, EF tàndem, barril catalític α/β, motius C2. Molt present a les cèl·lules piramidals de l'hipocamp, còrtex cerebral i cèl·lules epitelials. El domini PH és el que s'uneix amb les proteïnes citosòliques.
Distribució
En aquestes figures podem observar l'expressió tissular de les proteïnes PLCβ1, PLCβ2, PLCβ3, PLCβ4, PLCγ1, PLCγ2, PLCδ1, PLCδ3, PLCδ4, PLCε, PLCPη1 i PLCη2, analitzat pel projecte "The Human Protein Atles".




Estructura
L'estructura d eles fosfolipases és particular per a cada tipus isozim. Tot i així, té una estructura nuclear present en tots els isozims:

- Barril catalític α / β: S'encarrega de les funcions de catàlisi de les fosfolipases. El barril catalític es forma a partir de les regions X (147 residus) i Y (118 residus). El domini està format per α-hèlixs i làmines β. S'assembla a una triosa fosfat isomerasa (TIM) incompleta. Els residus catalítics es troben en l'extrem del barril, que està parcialment vorejat per residus hidrofòbics. Està format per una cavitat poc profunda a l'extrem carboxi-terminal. La punta forma una estructura semblant a un broc que pot permetre l'entrada i sortida dels reactius o productes a la superfície de la membrana. La seqüència que uneix les meitats X i Y del barril (43 residus) està molt desordenada i no forma part integral de l'estructura, tot i que pot tenir una funció reguladora important.
- Domini d'homologia de la pleckstrina (PH): Domini que s'encarrega d'unir la fosfolipasa C als fosfolípids, translocant la proteïna cap a la membrana. La majoria dels PLC eucariotes tenen un sol domini PH de (130 residus) situats a la regió amino-terminal. A vegades té un motiu PH addicional, que es troba a la regió Z de PLC-γ1 i -γ2, es divideix en dos dominis SH2 i un sol domini SH3. Les seqüències de PH no es conserven bé entre els PLC, cosa que suggereix la seva associació amb la regulació específica del subtipus. Curiosament, alguns PLC no tenen domini PH.
- Quatre dominis de mà EF tàndem: Domini que s'encarrega de captar el calci. Les isoformes PLC tenen fins a quatre motius de mà EF, cadascun consistint en una estructura d'hèlix-bucle-hèlix. Els motius es divideixen en lòbuls parells. La interessant juxtaposició al barril α / β catalític suggereix que el segon lòbul no forma part d'un interruptor de calci, sinó que és una part integral de l'estructura central de l'enzim. De fet, les deleccions en aquesta regió inactiven completament el PLC-δ1 de mamífers.
- Motius C2: Motiu que s'encarrega de dirigir les PLC cap a la membrana cel·lular. Els motius C2 (120 residus) s'han identificat sobretot en proteïnes funcionals en vies de senyalització lipídica. Consten de vuit làmines β antiparal·leles disposades com a sandvitx. És a dir, es poden superposar les seves cadenes principals. Tres bucles en un extrem del sandvitx β formen els llocs d'unió de fins a tres ions calci. Les regions d'unió al calci del domini δ1C2, designades (CBR) 1, 2 i 3, es conserven bé a les diverses isoformes que es troben en organismes que van des del llevat als humans, suggerint que s'ha mantingut alguna funció important.
Funcionament i implicacions biològiques
Activació
Totes les fosfolipases C mostren el mateix comportament enzimàtic, ja que en última instància totes produeixen DAG i IP3. Però els seus mecanismes d'activació són diferents segons la isoforma en particular. En absència d'estimulació, les PLC es mantenen en una activitat relativament feble ja que estan regulades per un mecanisme d'autoinhibició exercit per la regió que separa el domini X de l'Y al nivell del seu cor catalític: l'enllaç X/Y. Sota l'activació, per exemple, de les proteïnes G o l'ió Calci (Ca^2+), les PLC s'uneixen a la membrana per via del seu domini PH. Un cop les PLC es troben ancorades a la membrana els fosfolípids de membrana poden repèler l'enllaç X/Y, que allibera el centre catalític que permet l'hidròlisi de la PIP2.[28]
Activació de la PLC per l'activitat tirosina-cinases
Les fosfolipases Cɣ: LesPLCɣ són majoritàriament activades per receptors de l'activitat de la tirosina-cinasa (RTK): Són proteïnes de membrana monomèriques amb un domini extracel·lular responsable de la interacció amb el lligams, un domini transmembrana i un domini citoplasmàtic que té activitat enzimàtica. La fixació dels lligams a nivell de les RTKs possibilita la dimerizació dels receptors i l'autofosforilació de les tirosines a nivell de domini citoplamàtic. Les RTKs poden, aleshores, establir contacte amb les PLC que posseeixen dominis SH2 i lfosforilar-los. Aquesta última etapa indueix un canvi en la conformació de la PLC i una alliberació del lloc actiu de l'enzim.[29]
Activació de la PLC pel Ca2+
L'activitat de les PLCδ està altament lligada a l'activitat càlcica intracel·lular. La PLCδ1 pot ser activatada a partir de concentracions de Ca2+ entre 0.1 μM I 10 μM, que corresponen a les concentracions cel·lulars fisiològiques. Les PLCδ regula també aquells fenòmens de retrocontrol, l'homeòstasi del calci i inhibeix l'activitat dels canals sensibles les activitats del calci produïdes pel PIP2. Aquest tipus de regulació permet, d'altra manera l'amplificació de senyal: en efecte, com explicat anteriorment, l'activació de la PLC mobilitza l'activació de calci intracel·lular i així estimula encara més aquesta activitat hidrolítica de les fosfoinositidases reforçant així el senyal.

Modulació de la PLC por Altres factors
Existeixen una gran quantitat de factor que tenen una capacitat de modular la PLC.[30]
En absència de la tirosina cinasa, segons missatgers lipídics poden activar directament les isoenzimes de la PLC- y. Per exemple, l’àcid araquidònic, en presència de diferents tipus de proteïnes sintetitzades a la neurona (receptors de calci) o de proteïnes homòlogues, pot activar dits isoenzims. La fosfatidilcolina inhibeix aquest procés.[31]
A més a més, quan alguns ribonucleòtids trifosfat, difosfat i monofosfat es troben en
concentracions baixes tenen la capacitat d’inhibir la PLC- y (però en concentracions més altes)
La disponibilitat del substrat és un altre factor regulador de l’activitat de la PLC. El Ptdlns4.5P2 és el substat principal, però n’hi ha d’altres.[32]
Desensibilització de la PLC
En una gran quantitat de preparacions biològiques, quan els receptors acoplats a les proteïnes G es troben exposats als seus agonistes de manera prolongada, un procés regulatori s’inicia i atenua la señal del receptor. Aquest procés rep el nom de desensibilització.[33]
En referència a la desensibilització homòloga de la PLC a nivel de receptor, obtenim tres conclusions. Primerament, és un procés ràpid i, en moltes ocasions, parcial. D’altra manera, cada receptor té un mecanisme específic per una mateixa cèl·lula. Passa el mateix amb el grau d’atenuació. En tercer lloc, en funció del tipus cel·lular, el receptor és desensibilitzador de manera diferencial.[34]
Els mecanismes que participen en la desensibilització impliquen la fosforilació del receptor amb activitat proteïna-cinasa, disminució de l'eficiència del receptor a l’hora d’unirse a la proteïna i disminució de la quantitat de receptors en la superficie cel·lular.[35][36]
Inhibició
Elements autoinhibidors
- Connector X-Y: Ubicat dins del domini barril catalític α/β. Tot i que varia en funció de la PLCβ, consisteix en una cadena de 10-15 residus altament àcids i una regió terminal C. La divisió provocada pel connector X-Y incrementa. La suspensió d'aquest connector comporta una activació de la PLC. La càrrega negativa dels residus àcids causen una repulsió estèricament i electrostàtica que el centre actiu de la PLC entri en contacte amb la membrana ja que les càrregues negatives del lligam X/Y i la dels fosfolípids de membrana es repelen. D'aquesta manera el centre actiu de l'enzim no pot hidrolitzar la PIP2.
- Hèlix Hα2': Hèlix α unida al domini motius C2. Inhibeix l'activitat de la proteïna per mitjà de col·locar-se en una esquerda entre el domini barril catalític i el motiu C2.
Inhibidors externs
- Aminoesteroid U-73122 (C₂₉H₄₀N₂O₃): Fàrmac que inhibeix la hidròlisi i alliberament de la IP3 en cèl·lules amb sistemes danyats. La seva funció inhibidora ha estat qüestionada a l'observar que la seva presència pot augmentar l'activitat PLCγ[37]
- Manoalida (C25H36O5): Terpè bloquejador de canals de calci. Té una alta activitat inhibidora en les PLA. En les PLC, alliberat per la proteïna-quinasa i en pH bàsic pot inhibir la hidròlisi de PI2[38].
Patoligies
PLCB:
- b1: Epilèpsia encefalopàtica en nounats. Espasmes infantils i tara intelectual. Responsable també de disfunció cardíaca.
- b2: Disrupció del FMLP-superòxid estimulat en neutròfils.
- b3: Mort prematura. Fenotip més lleu en pacients amb fibrosi quística. Displàsia espondilmetafisària amb distròfia corneal.
- b4: Ataraxia. Melanoma uveal que sorgeix dels melanòcits (tumor de l'ull). Síndrome auriculocondil·lar.
PLCD:
- d1: Leuconíquia hereditària. Diferents tipus de càncer, malaltia trombòtica i autoimmunitat.
- d2: Relacionat amb diversos tipus de càncer. Hipertensió. Malaltia d’Alzheimer.
- d3: Mort embrionària. PLCδ1 i PLCδ3 comparteixen una homologia de seqüència alta i una distribució tisular similar i la pèrdua simultània causa la letalitat embrionària el dia embrionari a causa de l’apoptosi de trofoblasts placentaris i defectes de vascularització de la placenta
PLCG:
- G1: Participa en la metàstasi de càncer de mama. La seva inhabilitació bloqueja la metàstasi. (2) La pèrdua de PLCγ1 resulta en una vasculogènesi i eritrogènesi defectuoses. Gamma de limfomes de cèl·lules T que inclouen: limfomes de cèl·lules T angioimmunoblàstiques (AITL); leucèmia / limfoma de cèl·lules T per a adults (ATLL o ATL); limfoma de cèl·lules T hepatosplènic (HSTL); Micosi Fungoides; Síndrome de Sezary; limfomes perifèrics de cèl·lules T-no especificat altrament (PTCL-nos); limfomes derivats de cèl·lules T auxiliars fol·liculars (PTCL derivats de TFH); Leucèmia prolifocitària de cèl·lules T (TPLL)
- G2: La deficiència de PLCγ2 també va afectar la senyalització RANKL a les cèl·lules hematopoètiques, cosa que va provocar defectes en l’organogènesi dels ganglis limfàtics i la diferenciació dels osteoclasts. Malaltia inflamatòria intestinal (MII). Síndrome nefròtica sensible als esteroides (SSNS). CLL resistent a l’ibrutinib. Síndrome mielodisplàsica (MDS). Malaltia d’Alzheimer i altres demències.
PLCE:
- E1: L’ARNm de PLCε s’incrementa en el teixit miocàrdic de pacients amb cardiomiopatia dilatada idiopàtica, cosa que suggereix que el PLCε juga un paper en el desenvolupament de malalties cardíaques humanes. El silenci de PLCε mediat per siRNA en miòcits ventriculars de rata evita la hipertròfia induïda per agonistes. La sobreexpressió de PLCε en queratinòcits indueix una inflamació de la pell semblant a la psoriasi. Per contra, la pèrdua de PLCε atenua la CHS. La PLCε participa en la neuroinflamació.
PLCZ:
- Z1: En humans, es troben mutacions del gen PLCζ en pacients que van fallar repetidament en tractaments d’injecció d’espermatozoides citoplasmàtics. Aquestes mutacions PLCζ afecten la seva expressió i localització, així com la capacitat d’oscil·lació de Ca2 + dels espermatozoides. Per tant, el PLCζ participa en la infertilitat masculina d’humans.
Referències
- ↑ «Relationship between phosphatidylinositol synthesis and recovery of 5-hydroxytryptamine-responsive Ca2+ flux in blowfly salivary glands» (en anglès). J N Fain; M J Berridge, June,15,1979. [Consulta: 1r novembre 2020].
- ↑ Hofmann, S. L.; Majerus, P. W. «Modulation of phosphatidylinositol-specific phospholipase C activity by phospholipid interactions, diglycerides, and calcium ions». The Journal of Biological Chemistry, 257, 23, 10-12-1982, pàg. 14359–14364. ISSN: 0021-9258. PMID: 7142213.
- ↑ Hofmann, S. L.; Majerus, P. W. «Modulation of phosphatidylinositol-specific phospholipase C activity by phospholipid interactions, diglycerides, and calcium ions». The Journal of Biological Chemistry, 257, 23, 10-12-1982, pàg. 14359–14364. ISSN: 0021-9258. PMID: 7142213.
- ↑ Lee, K Y; Ryu, S H; Suh, P G; Choi, W C; Rhee, S G «Phospholipase C associated with particulate fractions of bovine brain.». Proceedings of the National Academy of Sciences of the United States of America, 84, 16, 1987-08, pàg. 5540–5544. ISSN: 0027-8424. PMID: 3475691.
- ↑ Rhee, Sue Goo «Reflections on the days of phospholipase C». Advances in Biological Regulation, 53, 3, 2013-09, pàg. 223–231. DOI: 10.1016/j.jbior.2013.08.004. ISSN: 2212-4934. PMID: 24054839.
- ↑ Katan, Matilda; Cockcroft, Shamshad «Phospholipase C families: Common themes and versatility in physiology and pathology» (en anglès). Progress in Lipid Research, 80, 01-11-2020, pàg. 101065. DOI: 10.1016/j.plipres.2020.101065. ISSN: 0163-7827.
- ↑ «Homo sapiens PLCB1 - Gene - NCBI».
- ↑ «PLCB1 Gene - GeneCards | PLCB1 Protein | PLCB1 Antibody».
- ↑ «PLCB2 phospholipase C beta 2 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCB2 Gene - GeneCards | PLCB2 Protein | PLCB2 Antibody».
- ↑ «PLCB3 phospholipase C beta 3 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCB3 Gene - GeneCards | PLCB3 Protein | PLCB3 Antibody».
- ↑ «PLCB4 phospholipase C beta 4 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCB4 Gene - GeneCards | PLCB4 Protein | PLCB4 Antibody».
- ↑ «PLCD1 phospholipase C delta 1 [Homo sapiens (human) - Gene - NCBI]».
- ↑ 16,0 16,1 16,2 16,3 16,4 Aloulou, Ahmed; Rahier, Renaud; Arhab, Yani; Noiriel, Alexandre; Abousalham, Abdelkarim «Phospholipases: An Overview». Methods in Molecular Biology (Clifton, N.J.), 1835, 2018, pàg. 69–105. DOI: 10.1007/978-1-4939-8672-9_3. ISSN: 1940-6029. PMID: 30109646.
- ↑ «PLCD1 Gene - GeneCards | PLCD1 Protein | PLCD1 Antibody».
- ↑ «PLCD3 Gene - GeneCards | PLCD3 Protein | PLCD3 Antibody».
- ↑ «PLCD3 phospholipase C delta 3 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCD4 Gene - GeneCards | PLCD4 Protein | PLCD4 Antibody».
- ↑ «PLCD4 phospholipase C delta 4 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCG1 phospholipase C gamma 1 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCG1 Gene - GeneCards | PLCG1 Protein | PLCG1 Antibody».
- ↑ «PLCG2 phospholipase C gamma 2 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCG2 Gene - GeneCards | PLCG2 Protein | PLCG2 Antibody».
- ↑ «PLCE1 phospholipase C epsilon 1 [Homo sapiens (human) - Gene - NCBI]».
- ↑ «PLCZ1 phospholipase C zeta 1 [Homo sapiens (human) - Gene - NCBI]».
- ↑ Grebert, Chloé. [https://tel.archives-ouvertes.fr/tel-02492604/document Rôle des phospholipases C dans la régulation de la sécrétion d’ions chlorure et de l’homéostasie calcique dans les cellules épithéliales bronchiques : intérêt dans la mucoviscidose] (tesi) (en francès). França: universitat de Poitiers, 29/11/2019, p. 177.
- ↑ Gresset, Aurelie; Sondek, John; Harden, T. Kendall «The phospholipase C isozymes and their regulation». Sub-Cellular Biochemistry, 58, 2012, pàg. 61–94. DOI: 10.1007/978-94-007-3012-0_3. ISSN: 0306-0225. PMC: 3638883. PMID: 22403074.
- ↑ Masgrau Juanola, Roser. Activació de la fosfolipasa C per receptors acoblats a proteïnes G en cultius de neurones granulars de cerebel. Paper modulador del calci (Tesi: Doctorat). Universitat Autònoma de Barcelona, 2000-06-02.
- ↑ Hwang, Sung Chul; Jhon, Deok-Young; Bae, Yun Soo; Kim, John Hyunshik; Rhee, Sue Goo «Activation of Phospholipase C-γ by the Concerted Action of Tau Proteins and Arachidonic Acid». Journal of Biological Chemistry, 271, 31, 02-08-1996, pàg. 18342–18349. DOI: 10.1074/jbc.271.31.18342. ISSN: 0021-9258.
- ↑ Cockcroft, S; Thomas, G M H «Inositol-lipid-specific phospholipase C isoenzymes and their differential regulation by receptors». Biochemical Journal, 288, 1, 15-11-1992, pàg. 1–14. DOI: 10.1042/bj2880001. ISSN: 0264-6021.
- ↑ Masgrau Juanola, Roser. Activació de la fosfolipasa C per receptors acoblats a proteïnes G en cultius de neurones granulars de cerebel. Paper modulador del calci (Tesi: Doctorat). Universitat Autònoma de Barcelona, 2000-06-02.
- ↑ Fisher, Stephen K.; Slowiejko, Diana M.; McEwen, Edward L. «A rapid attenuation of muscarinic agonist stimulated phosphoinositide hydrolysis precedes receptor sequestration in human SH-SY-5Y neuroblastoma cells». Neurochemical Research, 19, 5, 1994-05, pàg. 549–554. DOI: 10.1007/bf00971329. ISSN: 0364-3190.
- ↑ Fisher, Stephen K. «Homologous and heterologous regulation of receptor-stimulated phosphoinositide hydrolysis». European Journal of Pharmacology: Molecular Pharmacology, 288, 3, 1995-02, pàg. 231–250. DOI: 10.1016/0922-4106(95)90035-7. ISSN: 0922-4106.
- ↑ Cockcroft, S; Thomas, G M H «Inositol-lipid-specific phospholipase C isoenzymes and their differential regulation by receptors». Biochemical Journal, 288, 1, 15-11-1992, pàg. 1–14. DOI: 10.1042/bj2880001. ISSN: 0264-6021.
- ↑ «nhibition of phospholipase C dependent processes by U-73, 122» (en anglès). Bleasdale, J.E. Bundy, G.L. Bunting, S. Fitzpatrick, F.A. Huff, R.M. Sun, F.F. Pike, J.E., 1989. [Consulta: 3 novembre 2020].
- ↑ Bennett, C. F.; Mong, S.; Wu, H. L.; Clark, M. A.; Wheeler, L. «Inhibition of phosphoinositide-specific phospholipase C by manoalide». Molecular Pharmacology, 32, 5, 1987-11, pàg. 587–593. ISSN: 0026-895X. PMID: 3683364.
