Teoria de l'estat de transició
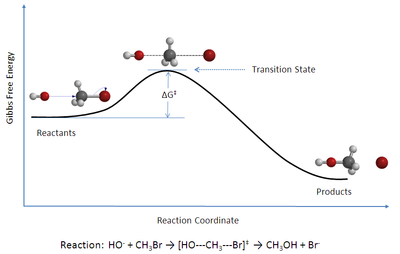
La teoria de l'estat de transició és una teoria que explica les velocitats de les reaccions químiques elementals. La teoria assumeix l'existència d'un tipus especial d'equilibri químic (quasi-equilibri) entre els reactius i el complex activat o estat de transició, una estructura intermèdia inestable per la seva alta energia.[1]
Aquesta teoria s'empra fonamentalment per a comprendre com es desenvolupen les reaccions químiques però no ha tingut molt d'èxit en el seu objectiu inicial de calcular les constants de velocitat, per a la qual cosa es requereix un coneixement precís de les superfícies d'energia potencial.[2] Sí que ha permès calcular les entalpies estàndard d'activació (Δ‡H), les entropies estàndard d'activació (Δ‡S), les energies lliures d'activació (Δ‡G) d'una determinada reacció si s'ha determinat experimentalment el seu constant de velocitat. (La notació ‡ es refereix que el valor en qüestió està mesurat en l'anomenat 'estat de transició'.)Aquesta teoria fou desenvolupada simultàniament el 1935 per Henry Eyring, en la universitat de Princeton, i per Meredith Gwynne Evans i Michael Polanyi de la Universitat de Manchester.[3][4] També es coneix aquesta teoria amb el nom de “teoria del complex activat”, “teoria de velocitats absolutes”, i “teoria de les velocitats absolutes de reacció”.[5]
Abans del desenvolupament d'aquesta teoria, l'equació d'Arrhenius era usada àmpliament per a determinar barreres d'energia d'una reacció (diferència d'energia del complex activat menys la dels reactius). L'equació d'Arrhenius sorgeix d'observacions empíriques i ignora tota consideració sobre el mecanisme, com per exemple si estan implicats un o més estats intermedis en la conversió global d'un reactiu en un producte.[6] Per tant, fou necessari un desenvolupament posterior per a comprendre els dos paràmetres associats amb aquesta llei, el factor preexponencial (A) i l'energia d'activació (Ea). La teoria de l'estat de transició tracta amb èxit aquestes dues qüestions, transcorrent 46 anys entre la publicació de la llei de velocitat d'Arrhenius el 1889 i l'equació d'Eyring basada en la teoria de l'estat de transició el 1935. En aquest període, el treball de molts científics i investigadors contribuïren significativament al desenvolupament d'aquesta teoria.
Fonament de la teoria
[modifica]Les idees bàsiques de la teoria de l'estat de transició són:
- Les velocitats de les reaccions es coneixen estudiant els complexos activats que es troben a la cima (punt superior) d'una superfície d'energia potencial. No són importants els detalls de formació d'aquests complexos activats.
- Els complexos activats estan en un equilibri especial (quasi-equilibri) amb les molècules de reactiu.
- Els complexos activats poden convertir-se en productes la qual cosa permet a la teoria cinètica calcular la velocitat d'aquesta conversió.
Desenvolupament
[modifica]La mecànica estadística tingué un paper significatiu en el desenvolupament de la teoria de l'estat de transició. Això no obstant, l'aplicació de la mecànica estadística a la teoria de l'estat de transició es desenvolupà molt lentament perquè, a mitjan segle xix, James Clerk Maxwell, Ludwig Boltzmann i Leopold Pfaundler publicaren diversos articles discutint les reaccions en equilibri i les velocitats de reacció, en termes del moviment molecular i la distribució estadística de les velocitats moleculars.
No fou fins al 1912 quan el químic suís Alfred Berthoud emprà la llei de distribució de Maxwell-Boltzmann per a obtenir una expressió per a la constant de velocitat:
On i són constants relacionades amb termes d'energia.
Dos anys després, René Marcelin realitzà una contribució essencial considerant el progrés d'una reacció química com el moviment d'un punt en un espai de fases. Després aplicà els procediments mecanico-estadístics de Gibbs i obtingué una expressió semblant a la que havia obtingut anteriorment a partir de consideracions termodinàmiques.
El 1915, una altra important contribució fou realitzada pel físic britànic James Rice. Basant-se en la seva anàlisi estadística, conclogué que la constant de velocitat és proporcional a l'«increment crític». Les seves idees foren desenvolupades més tard per Richard Pare Tolman. El 1919, el físic austríac Karl Ferdinand Herzfeld applicà la mecànica estadística a la constant d'equilibri i la teoria cinètica a la constant de velocitat de la reacció inversa, k-1, per a la dissociació reversible d'una molècula diatòmica.
Obtingué la següent equació per a la constant de velocitat de la reacció directa:
On:
- és l'energia de dissociació en el zero absolut
- és la constant de Boltzmann
- és la constant de Planck
- és la temperatura termodinàmica
- és la freqüència vibracional de l'enllaç
Aquesta expressió és molt important, ja que és la primera vegada que el factor , que és un component crític de la teoria de l'estat de transició, apareix en una equació de velocitat.
En 1920, el químic nord-americà Richard Chase Tolman desenvolupà addicionalment la idea de Rice de l'«increment crític». Conclogué que l'«increment crític» (ara anomenat energia d'activació) d'una reacció és igual a l'energia mitjana de totes les molècules sotmeses a reacció menys l'energia mitjana de totes les molècules de reactiu.
Superfícies d'energia potencial
[modifica]El concepte de superfície d'energia potencial fou molt important en el desenvolupament de la teoria de l'estat de transició. La base d'este concepte fou establida per Marcelin. Ell va teoritzar que el progrés d'una reacció química podia descriure's com un punt en una superfície d'energia potencial amb coordenades de moments atòmics i distàncies.
El 1931, Eyring i Polanyi construïren una superfície d'energia potencial per a la reacció:
Aquesta superfície és un diagrama tridimensional basat en els principis mecano-quàntics així com en dades experimentals de freqüències vibracionals i energies de dissociació.
Un any després de la construcció d'Eyring i Polanyi, H. Pelzer i Eugene Wigner feren una important contribució seguint el progrés d'una reacció sobre una superfície d'energia potencial, on es discutia per primera vegada el concepte de punt de cadira o punt singular en una superfície d'energia potencial. Conclogueren que la velocitat d'una reacció es determina pel moviment del sistema a través d'aquest punt de cadira.
Limitacions de la teoria de l'estat de transició
[modifica]En general, la teoria de l'estat de transició ha subministrat als investigadors una base conceptual per a comprendre com tenen lloc les reaccions químiques. Encara que la teoria és àmpliament acceptada, té limitacions. Per exemple, la teoria suposa que una vegada que l'estructura de transició comença a baixar per la superfície d'energia potencial, conduïx a un producte (o un conjunt de productes). Això no obstant, en algunes reaccions, l'estat de transició pot travessar la superfície d'energia potencial de tal manera, que condueix a una inesperada selectivitat de producte no predita per la teoria de l'estat de transició (un exemple de tals reaccions és la descomposició tèrmica de diazobiciclopentans, presentada per Eric V. Anslyn i Dennis A. Doughtery).
La teoria de l'estat de transició està també basada en la suposició que els nuclis atòmics es comporten d'acord amb la mecànica clàssica.[7] Se suposa que llevat que els àtoms o les molècules col·lidisquen amb suficient energia per a formar l'estructura de transició, o bé la reacció no ocorrerà. Això no obstant, d'acord amb la mecànica quàntica, per a qualsevol barrera d'energia de valor finit, hi ha una possibilitat que les partícules puguen escapar per efecte túnel a través de la barrera. Respecte a les reaccions químiques això significa que hi ha una oportunitat perquè les molècules reaccionen inclús si no col·lidixen amb suficient energia per a travessar la barrera d'energia.[8] Mentre s'espera que aquest efecte siga insignificant per a reaccions amb energies d'activació grans, arriba no obstant a ser un fenomen més important per a reaccions amb barreres d'energia relativament baixes, ja que la probabilitat d'efecte túnel augmenta com menor és l'altura de la barrera.
La teoria de l'estat de transició falla per a algunes reaccions a alta temperatura. La teoria suposa que el sistema reaccionant sobrepassarà el punt de cadira d'energia més baixa en la superfície d'energia potencial. Recordem que el punt de major energia d'aquest punt de cadira s'anomena estat de transició. Mentre aquesta descripció és consistent per a reaccions que ocorren a temperatures relativament baixes, a altes temperatures, les molècules es distribuïxen en els modes de major energia vibracional; el seu moviment es fa més complex i les col·lisions poden conduir a estats de transició allunyats d'allò que s'ha previst per la teoria de l'estat de transició. Aquesta desviació de la teoria de l'estat de transició s'observa inclús en la reacció simple d'intercanvi entre hidrogen diatòmic i un radical hidrogen.[9]
Referències
[modifica]- ↑ International Union of Pure and Applied Chemistry (IUPAC) Gold Book. Transition State Theory. http://goldbook.iupac.org/T06470.html (últim accés 3 d'octubre del 2009)
- ↑ Truhlar, D.G.; Garrett, B.C.; Klippenstein, S.J., Current Estatus of Transition-State Theory. The Journal of physical chemistry 1996, 100, (31), 12771-12800
- ↑ Laidler, K.; King, C, Development of transition-state theory. The Journal of physical chemistry 1983, 87, (15), 2657
- ↑ Laidler, K.; King, C, A lifetime of transition-state theory. The chemical intelligencer 1998, 4, (3), 39
- ↑ Laidler, K.J., Theories of Chemical Reaction Rates (McGraw-Hill Sèries in Advanced Chemistry). 1969; p 234 Pp.
- ↑ Eric V. Anslyn and Dennis A. Dougherty. Transition State Theory and Related Topics. In Modern Physical Organic Chemistry University Science Books: 2006; Pp 365-373
- ↑ Eyring, H.; Journal of Chemical Physics, 1935, 3, 107-115
- ↑ Masel, R. Principles of Adsorption and Reactions on Solid Surfaces; Wiley, New York, 1996
- ↑ Pineda, J. R.; Schwartz, S. D.; Philosophical Transactions of the Royal Society B 2006, 361, 1433-1438












