Proteïna-cinasa: diferència entre les revisions
Pàgina nova, amb el contingut: «thumb|250px|right|Fosoforilació de la proteïna Una '''proteïna quinasa''' és un enzim quinasa que modifica unes altres [...». |
(Cap diferència)
|
Revisió del 13:24, 23 gen 2012
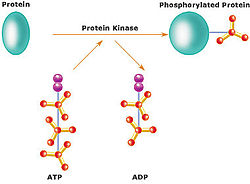
Una proteïna quinasa és un enzim quinasa que modifica unes altres proteïnes per addició química de grups fosfat (fosforilació). La fosforilació normalment resulta en un canvi funcional de la proteïna objectiu (substrat) per canvi de l’activitat dels enzims, localització cel·lular, o associació amb altres proteïnes. El genoma humà conté unes 500 gens de proteïnes quinasa i constitueixen un 2% de tots els gens humans.[1] Les proteïnes quinases també es troben en els bacteris i les plantes. Més del 30% de totes les proteïnes humanes poden ser modificades per l’activitat dela quinasa, i se sap que les quinases regulen la majoria de les vies cel·lulars, especialment aquelles que estan implicades en la transducció del senyal.
Activitat química
L’activitat química de la quinasa implica transferir un grup fosfat d’un trifosfat nucleòsid (normalment ATP) i unir-lo covalentment a uns altres tres aminoàcids que tenen un grup hidroxil. La majoria de les quinases actuen sobre ambdues serina i treonina, altres actuen sobre la tirosina, i un gran nombre de (quinases d'especificitat dual) actuen en totes tres.[2] També hi ha proteïnes quinasa que fosforilen altres aminoàcids, incloent les histidina quinasa que fosoforilen residus químics d'histidina.[3]
Regulació
Pel fet que les proteïnes quinasa tenen efectes profunds sobre la cèl·lula, la seva activitat està altement regulada. Les quinases s’activen i desactiven per la fosforilació (de vegades per la mateixa cis fosforilació’/autofosforilació),enllaçant activadors de proteïnes o proteïnes inhibidores, o petites molècules, o per control de la seva localització en la cèl·lula respecte els seus substrats..
Estructura
Les subunitats catalítiques de moltes proteïnes quinasa són molt conservades en la seva seqüència i s’han dilucidat diverses estructures.[4]
Les proteïnes quinases eucariotes són enzims que pertanyen a l’extensa família de les proteïnes que comparteixen un nucli catalític conservat.[5][6][7][8]
Grups de proteïnes quinasa
La família de proteïnes quinasa humanes es divideix en els següents grups:
- Quinases AGC – que contenen PKA, PKC i PKG.
- quinases CaM – contenen les proteïnes quinasa calci/calmodulina-dependent.
- CK1 – contenen el grup quinasa caseïna 1 .
- CMGC – contenen les quinases CDK, MAPK, GSK3 i CLK
- STE - contenen els homòlegs de les quinases de llevat Sterile 7, Sterile 11, i Sterile 20.
- TK - contenen les quinases tirosina.
- TKL – contenen el grup de quinases similar a tirosina-quinasa .
Proteïna quinasa específiques de la serina/treonina

Referències
- ↑ Manning G, Whyte DB. et al. «The protein kinase complement of the human genome». Science, vol. 298, 5600, 2002, pàg. 1912–1934. DOI: 10.1126/science.1075762. PMID: 12471243.
- ↑ Dhanasekaran N, Premkumar Reddy E «Signaling by dual specificity kinases». Oncogene, vol. 17, 11 Reviews, September 1998, pàg. 1447–55. DOI: 10.1038/sj.onc.1202251. PMID: 9779990.
- ↑ Besant PG, Tan E, Attwood PV «Mammalian protein histidine kinases». Int. J. Biochem. Cell Biol., vol. 35, 3, March 2003, pàg. 297–309. DOI: 10.1016/S1357-2725(02)00257-1. PMID: 12531242.
- ↑ Stout TJ, Foster PG, Matthews DJ «High-throughput structural biology in drug discovery: protein kinases». Curr. Pharm. Des., vol. 10, 10, 2004, pàg. 1069–82. DOI: 10.2174/1381612043452695. PMID: 15078142.
- ↑ Hanks SK «Genomic analysis of the eukaryotic protein kinase superfamily: a perspective». Genome Biol., vol. 4, 5, 2003, pàg. 111. DOI: 10.1186/gb-2003-4-5-111. PMC: 156577. PMID: 12734000.
- ↑ Hanks SK, Hunter T «Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification». FASEB J., vol. 9, 8, May 1995, pàg. 576–96. PMID: 7768349.
- ↑ Hunter T «Protein kinase classification». Meth. Enzymol., vol. 200, 1991, pàg. 3–37. DOI: 10.1016/0076-6879(91)00125-G. PMID: 1835513.
- ↑ Hanks SK, Quinn AM «Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members». Meth. Enzymol., vol. 200, 1991, pàg. 38–62. DOI: 10.1016/0076-6879(91)00126-H. PMID: 1956325.
Enllaços externs
- The Protein Kinase Resource: (new link!)Curated database of protein kinase structures and related data
- Human and mouse protein kinases: classification and index
- The Kinase Knowledgebase (KKB): Database of kinase structure-activity and chemical synthesis data.
- Kinase.Com: Genomics, evolution and large-scale analysis of protein kinases (non-commercial).
- Kinase/TIP: Database containing thousands of protein structures, co-complexes and models surveying the Human Kinome.
- AurSCOPE Kinase Database
- Kinasecentral: Information on Kinase inhibitors in development
- Collection of Ser/Thr/Tyr specific protein kinases and similar sequences
- KinMutBase: A registry of disease-causing mutations in protein kinase domains
- Human kinome by Manning et al.
- UMichOPM families|superfamily|63 - Orientations of C1 domains of protein kinases in membranes
- UMichOPM families|superfamily|47 - Orientations of C2 domains of protein kinases and other proteins in membranes
- Huaxian Chen, et al. A Cell Based Immunochemical Assay for Monitoring Kinase Signaling Pathways and Drug Efficacy (PDF) Analytical Biochemistry 338 (2005) 136-142
- MAP Kinase Resource
