Germà (compost)
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 77,952 Da |
| Estructura química | |
| Fórmula química | GeH₄ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Moment dipolar elèctric | 0 D |
| Punt de fusió | −166 °C −165 °C |
| Punt d'ebullició | −88 °C (a 760 Torr) −90 °C (a 101,325 kPa) |
| Moment dipolar elèctric | 0 D |
| Pressió de vapor | 1 atm (a 20 °C) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 0,6 mg/m³ (10 h, cap valor) |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Altres | |
| gas inflamable | |
El germà, o tetrahidrur de germani, és un compost químic molecular constituït per àtoms de germani i d'hidrogen, és un hidrur de fórmula . A temperatura ambient és un gas incolor amb una olor picant i inflamable. És més pesant que l'aire i una flama pot tornar a la font de la fuita amb molta facilitat. És tòxic per inhalació. L'exposició prolongada dels contenidors al foc o a la calor intensa pot provocar la seva ruptura i coets violents. S'utilitza en la fabricació d'electrònica.
Història[modifica]
El primer hidrur de germani fou obtingut el 1902 per E. Voegelen, de la Universitat de Würzburg a Baviera, Alemanya, en fer reaccionar zinc amb tetraclorur de germani en presència d'àcid sulfúric.[1] Voegelen treballà amb petites quantitats i no obtingué l'hidrur en estat pur, sinó que es limità a determinar la composició de l'hidrur existent en una barreja diluïda amb hidrogen a partir del qual pogué separar l'hidrur. Feu reaccionar l'hidrur de germani amb una sal d'argent, precipitant així germanur d'argent , i la mescla també es passà sobre sofre finament dividit, convertint així l'hidrur en sulfur. L'anàlisi d'aquests dos productes suggerí la fórmula , el germà.[2]
Estructura[modifica]
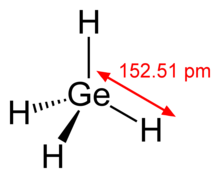
Els àtoms de germani presenten hibridació sp3, per la qual cosa poden formar quatre enllaços covalents simples (enllaços sigma) dirigits segons els vèrtexs d'un tetraedre, separats 109,5°, igual que els àtoms de carboni perquè són elements del mateix grup 14 de la taula periòdica. Les longituds dels enllaços amb els àtoms d'hidrogen creix amb el volum atòmic dels elements, que és proporcional al nombre màssic. L'enllaç té una longitud de 152,5 pm, la de l'enllaç és de 148,0 pm i la del només és de 108,7 pm. S'observa que a mesura que augmenta el volum atòmic s'incrementa la distància d'enllaç.[3]
Els enllaços són més febles que els , i aquests més febles que els . Les energies d'enllaç en kJ/mol són 263,6; 326,8 i 607,2, respectivament. Així la força de l'enllaç és un poc inferior a la meitat de la força . Pel que fa als enllaços amb els hidrògens, són un poc més febles els que els i que els , però la diferència és poc significativa. En kJ/mol són respectivament: 321,7; 299,2; 338,4.[4]
Propietats[modifica]

Propietats físiques[modifica]
A temperatura ambient el germà és un gas incolor amb una olor picant. El seu punt de fusió és de –165 °C i el d'ebullició –88,5 °C. La seva densitat és de 3,133 g/L (2,65 vegades superior a la de l'aire).[5]
Propietats químiques[modifica]
Escalfant el germà s'obtenen altres germans, altres hidrurs de germani. Per exemple el digermà i el trigermà :[6]
Amb l'oxigen el germà dona el diòxid de germani:
Preparació[modifica]
El germà es pot preparar mitjançant diversos mètodes:
- Reducció de tetraclorur de germani amb hidrur d'alumini i liti en èter etílic.[7]
- Electròlisi d'una solució de diòxid de germani en àcid sulfúric mitjançant elèctrodes de plom, i
- Reacció de germanur de magnesi i bromur d'amoni en amoníac líquid.[7]
Referències[modifica]
- ↑ Voegelen, E. «Über Germaniumwasserstoff». Zeitschrift für anorganische Chemie, 30, 1, 16-04-1902, pàg. 325–330. DOI: 10.1002/zaac.19020300127. ISSN: 0863-1778.
- ↑ Johnson, Otto H. «The Germanes and their Organo Derivatives.». Chemical Reviews, 48, 2, 01-04-1951, pàg. 259–297. DOI: 10.1021/cr60150a003. ISSN: 0009-2665.
- ↑ «CCCBDB listing of experimental data page 2». [Consulta: 24 febrer 2022].
- ↑ William M. Haynes. CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data.. 93rd ed., 2012-2013. Boca Raton, Fla.: CRC, 2012. ISBN 978-1-4398-8049-4.
- ↑ PubChem. «Germane» (en anglès). [Consulta: 9 març 2022].
- ↑ J. J. Zuckerman, A. P. Hagen. Inorganic Reactions and Methods, The Formation of the Bond to Hydrogen (Part 2). Deerfield Beach, Fla.: VCH Publishers, 1987. ISBN 978-0-470-14537-1.
- ↑ 7,0 7,1 «GERMANE | 7782-65-2». ChemicalBook. [Consulta: 9 març 2022].
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Germà |




















