Cicle de Carnot

El cicle de Carnot es produeix quan una màquina treballa absorbint una quantitat de calor Q1 de la font d'alta temperatura i cedeix una calor Q₂ a la de baixa temperatura produint un treball sobre l'exterior. El rendiment ve definit, com en tot cicle, per:
i, com es veurà endavant, és més gran que qualsevol màquina que funcioni cíclicament entre les mateixes fonts de temperatura. Una màquina tèrmica que realitza aquest cicle es denomina màquina de Carnot.
Com tots els processos que tenen lloc en el cicle ideal són reversibles, el cicle pot invertir-se. Llavors la màquina absorbeix calor de la font freda i cedeix calor a la font calenta, havent de subministrar treball a la màquina. Si l'objectiu d'aquesta màquina és extreure calor de la font freda s'anomena màquina frigorífica, i si és aportar calor a la font calenta bomba de calor.
Etapes[modifica]
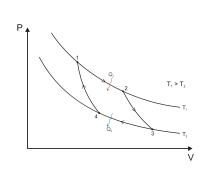

El cicle de Carnot consta de quatre etapes: dos processos isotèrmics (a temperatura constant) i dos d'adiabàtics (aïllats tèrmicament). Les aplicacions del primer principi de la termodinàmica estan escrits d'acord amb el criteri de signes termodinàmic.
1. Expansió isoterma: (procés 1 → 2 en el diagrama) Es parteix d'una situació en què el gas es troba al mínim volum del cicle i a la temperatura T1 de la font calenta. En aquest estat es transfereix calor al cilindre des de la font de temperatura T1, fent que el gas s'expandeixi. En expandir-se, el gas tendeix a refredar-se, però absorbeix calor de T1 i manté la seva temperatura constant. Es tracta d'un gas ideal, en no canviar la temperatura tampoc ho fa la seva energia interna, i menyspreant els canvis en l'energia potencial i l'cinètica, a partir de la 1a llei de la termodinàmica veiem que tot el calor transferit és convertit en treball:
Des del punt de vista de la entropia, aquesta augmenta en aquest procés: per definició, una variació d'entropia ve donada pel quocient entre la calor transferida i la temperatura de la font en un procés reversible: . Com que el procés és efectivament reversible, l'entropia augmentarà
2. Expansió adiabàtica : (2 → 3) L'expansió isoterma acaba en un punt tal que la resta de l'expansió pugui realitzar sense intercanvi de calor. A partir d'aquí el sistema s'aïlla tèrmicament, de manera que no hi ha transferència de calor amb l'exterior. Aquesta expansió adiabàtica fa que el gas es refredi fins a aconseguir exactament la temperatura T₂ en el moment en què el gas arriba el seu volum màxim. En refredar disminueix la seva energia interna, de manera que utilitzant un raonament anàleg a l'anterior procés:
Aquesta vegada, en no haver-hi transferència de calor, l'entropia es manté constant:
3. Compressió isoterma : (3 → 4) Es posa en contacte amb el sistema la font de calor de temperatura T 2 i el gas comença a comprimir, però no augmenta la seva temperatura perquè va cedint calor a la font freda. En no canviar la temperatura tampoc ho fa l'energia interna, i la cessió de calor implica que cal fer un treball sobre el sistema:
Com que la calor negatiu, l'entropia disminueix:
4. Compressió adiabàtica : (4 → 1) Aïllat tèrmicament, el sistema evoluciona comprimint i augmentant la seva temperatura fins a l'estat inicial. L'energia interna augmenta i la calor és nul·la, de manera que cal aplicar un treball al sistema:
Com que és un procés adiabàtic, no hi ha transferència de calor, per tant l'entropia no varia:
Treball del cicle[modifica]
Per convenció de signes, un treball negatiu significa que el treball és realitzat sobre el sistema.
Amb aquest conveni de signes el treball obtingut haurà de ser, per tant, negatiu. Tal com està definit, i menyspreant els canvis en energia mecànica, a partir de la primera llei:
Com que dU (diferencial de l'energia interna) és una diferencial exacta, el valor d'U és el mateix a l'inici i al final del cicle, i és independent del camí, per tant la integral de dU val zero, i per tant tenim que:
Per tant, en el cicle el sistema ha realitzat un treball sobre l'exterior.
Teoremes de Carnot[modifica]
1. No pot existir una màquina tèrmica que funcionant entre dues fonts tèrmiques donades que tingui major rendiment que una de Carnot que funcioni entre aquestes mateixes fonts tèrmiques.
- Per demostrar-ho suposarem que no es compleix el teorema, i es veurà que el no compliment transgredeix la segona llei de la termodinàmica. Tenim doncs dues màquines, una trucada X i una altra, de Carnot, R, operant entre les mateixes fonts tèrmiques i absorbint la mateixa calor de la calenta. Com que suposem que , i per definició
, on i denoten el treball produït i la calor cedida a la font freda respectivament, i els subíndexs la màquina a la qual es refereixen.
- Com que R és reversible, es pot fer funcionar com una màquina frigorífica. Com que , la màquina X pot subministrar a R el treball que necessita per a funcionar com a màquina frigorífica, i X produirà un treball net . Com que funciona en sentit invers, R està absorbint calor de la font freda i està cedint calor a la calenta.
- El sistema format per les dues màquines funciona cíclicament realitzant un treball i intercanviant una calor amb una única font tèrmica, la qual cosa va en contra del segon principi de la termodinàmica. Per tant:
2. Dues màquines reversibles operant entre les mateixes fonts tèrmiques tenen el mateix rendiment.
- Igual que abans, suposem que no es compleix el teorema i veurem que es violarà el segon principi. Siguin R1 i R 2 dues màquines reversibles, operant entre les mateixes fonts tèrmiques i absorbint la mateixa calor de la calenta, amb diferents rendiments. Si és R1 la de menor rendiment, llavors .
- Invertint R1, la màquina R₂ pot subministrar el treball perquè treballi com a màquina frigorífica, i R₂ produirà un treball .
- El sistema format per les dues màquines funciona cíclicament realitzant un treball i intercanviant una calor amb una única font tèrmica, la qual cosa va en contra de la segona llei. Per tant:
Rendiment[modifica]
A partir del segon teorema de Carnot es pot dir que, com que dues màquines reversibles tenen el mateix rendiment, aquest serà independent de la substància de treball de les màquines, les propietats o la forma en què es realitzi el cicle. Només dependrà de les temperatures de les fonts entre les que treballi. Si tenim una màquina que treballa entre fonts a temperatura T1 i T₂, el rendiment serà una funció de les dues com a variables:
Per tant, el quocient entre les calors transferides és funció de les temperatures de les fonts. Nota: com que, per la segona llei de la termodinàmica, el rendiment no pot ser mai igual a la unitat, la funció f està sempre definida.
Considerem ara tres màquines que treballen entre fonts a temperatures tals que . La primera màquina treballa entre les fonts 1 i 2, la segona entre 1 i 3, i la tercera entre 3 i 2, de manera que cada font intercanvia la mateixa calor amb les màquines que actuen sobre ella. És a dir, tant la primera màquina com la segona absorbeixen una calor Q1, la segona i la tercera cedeixen i absorbeixen Q₂ respectivament i la primera i la tercera cedeixen Q₃. De l'equació anterior podem posar, aplicada a cada màquina:
Aplicant relacions matemàtiques:
Com que el primer membre és funció només de T1 i T₂, també ho serà el segon membre, independentment de T₃. Perquè això es compleixi f ha de ser de la forma
De les diferents funcions que satisfan aquesta condició, la més senzilla és la proposada per Kelvin, , de manera que el quocient entre calors queda
i traslladant aquest quocient a la definició de rendiment:
Una altra forma d'arribar a aquest resultat és a través de l'entropia, definida com . D'aquí es pot treure les calors transferides en els processos 1 → 2 i 3 → 4:
Com es pot observar, la calor transferida amb la primera font és positiva i amb la segona negativa, pel conveni de signes adoptat.
Tenint en compte que per calcular el rendiment d'un cicle s'utilitzen els valors absoluts dels treballs i les calors,
tenim finalment el resultat desitjat:
Cicle real[modifica]
Tots els processos reals tenen alguna irreversibilitat, ja sigui mecànica per fregament, tèrmica o d'un altre tipus. No obstant això, les irreversibilitats es poden reduir, i es pot considerar reversible un procés quasiestàtic i sense efectes dissipatius. Els efectes dissipatius es redueixen minimitzant el fregament entre les diferents parts del sistema i els gradients de temperatura, el procés és quasiestàtic si la desviació de l'equilibri termodinàmic és a màxim infinitesimal, és a dir, si el temps característic del procés és molt més gran que el temps de relaxació (el temps que transcorre entre que s'altera l'equilibri fins que es recupera). Per exemple, si la velocitat amb què es desplaça un èmbol és petita comparada amb la del so del gas, es pot considerar que les propietats són uniformes espacialment, ja que el temps de relaxació mecànic és de l'ordre de V 1/3 /a (on V és el volum del cilindre i a la velocitat del so), temps de propagació de les ones de pressió, molt més petit que el temps característic del procés, V 1/3 /w (on w és la velocitat de l'èmbol), i es poden menysprear les irreversibilitats.
Si es fa que els processos adiabàtics del cicle siguin lents per minimitzar les irreversibilitats es fa impossible de frenar la transferència de calor. Com que les parets reals del sistema no poden ser completament adiabàtiques, l'aïllament tèrmic és impossible, sobretot si el temps característic del procés és llarg. A més, en els processos isoterms del cicle hi ha irreversibilitats inherents a la transferència de calor. Per tant, és impossible aconseguir un cicle real lliure d'irreversibilitats, i pel primer teorema de Carnot l'eficiència serà menor que per a un cicle ideal.
Vegeu també[modifica]
- Cicle Otto
- Cicle Atkinson
- Cicle Brayton
- Cicle Miller
- Cicle Stirling
- Cicle Ericsson
- Cicle termodinàmic
Bibliografia[modifica]
- Jesús Biel Gaye: Formalismes i Mètodes de la Termodinàmica, Vol 1 . Editorial Reverté. ISBN 84-291-4343-2









































