Usuari:Mcapdevila/Voltamperometria
La voltamperometria és una categoria dels mètodes electroanalítics usats en química analítica i diversos processos industrials. A voltamperometria la informació sobre un analit s'obté mesurant el corrent quan es modifica el potencial elèctric.[1] [2]
Sistema de tres elèctrodes[modifica]


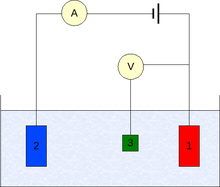
Els experiments de voltamperometria investiguen la reactivitat a la semicel·la d'un analit. La majoria dels experiments controlen el potencial elèctric (volts) d'un elèctrode en contacte amb l'analit, mentre que es mesura el corrent resultant (amperes ).[3]
Per dur a terme un experiment es requereixen com a mínim dos elèctrodes. L'elèctrode de treball, que fa contacte amb l'analit, ha d'aplicar el potencial desitjat d'una manera controlada i facilitar la transferència de electrons des de i cap a l'analit. Un segon elèctrode actua com l'altra semicel·la. Aquest segon elèctrode ha de tenir un potencial conegut amb el qual mesurar el potencial de l'elèctrode de treball, a més, s'han d'equilibrar els electrons afegits o eliminats per l'elèctrode de treball. Si bé aquesta és una configuració viable, té una sèrie de deficiències. Més significativament, és extremadament difícil per a un elèctrode mantenir un potencial constant mentre que passa el corrent per fer front als esdeveniments redox de l'elèctrode de treball.
Per resoldre aquest problema, el paper de proveïdor d'electrons i el de potencial de referència s'ha dividit entre dos elèctrodes separats. El elèctrode de referència és una semicel·la amb un potencial de reducció de conegut. La seva única funció és actuar com a referència en el mesurament i controlar el potencial dels elèctrodes de treball i en cap moment passa cap corrent. El elèctrode auxiliar passa tot el corrent necessària per a equilibrar el corrent observada en l'elèctrode de treball. Per aconseguir aquest corrent, l'auxiliar sovint oscil als potencials extrems en les vores de la finestra de dissolvent, on s'oxida o redueix el solvent o electròlit de suport. Aquests elèctrodes, el de treball, el de referència, i l'auxiliar constitueixen el modern sistema de tres elèctrodes.
Hi ha molts sistemes que tenen més elèctrodes, però els seus principis de disseny són generalment els mateixos com el sistema de tres elèctrodes. Per exemple, el elèctrode de disc-anell rotatori té dos elèctrodes de treball diferents i separats, un disc i un anell, que pot usar-se explorar o mantenir potencials independentment un de l'altre. Tots dos elèctrodes estan equilibrats per una simple combinació del de referència i l'auxiliar per formar un disseny de quatre elèctrodes. Experiments més complicats poden afegir tants elèctrodes de TREBALL com es requereixi i de vegades elèctrodes de referència i auxiliar.
A la pràctica pot ser molt important comptar amb un elèctrode de treball amb característiques de dimensions i superfície conegudes. Com a resultat d'això, és comú netejar i polir els elèctrodes de treball amb regularitat. L'elèctrode auxiliar pot ser gairebé qualsevol cosa per tal que no reaccioni amb la major part de la solució de l'analit i condueixi bé. El de referència és el més complex dels tres elèctrodes, s'utilitzen una varietat d'estàndards i que val la pena investigar. Per treballs no aquosos, la IUPAC recomana l'ús de la parella ferrocè/ferrocenium com un estàndard intern. En la majoria dels experiments de voltamperometria un electròlit inert (també conegut com a electròlit suport) s'utilitza per reduir al mínim la resistència de la solució. Pot ser possible realitzar un experiment sense un electròlit suport, però la resistència afegida enormement redueix l'exactitud dels resultats. En el cas de líquids iònics a temperatura ambient iònic el dissolvent pot actuar com a electròlit.
Teoria[modifica]
L'anàlisi de dades requereix la consideració de la cinètica, a més de la termodinàmica, a causa del component temporal de la voltamperometria. Idealitzades relacions termodinàmiques electroquímiques teòriques, com ara l'equació de Nernst estan elaborades sense una component de temps. Tot i que aquests models són insuficients per si mateixos per descriure els aspectes dinàmics de la voltamperometria, models com l'equació de Nernst i l'equació de Butler-Volme sentin les bases per a les relacions de voltamperometria modificades que relacionen la teoria amb els resultats observats.[4]
Tipus de voltamperometria[modifica]
- Voltamperometria d'escombratge lineal
- Voltamperometria esglaonada
- Voltamperometria d'ona quadrada
- Voltamperometria cíclica - Un mètode voltamètric que es poden utilitzar per determinar els coeficients de difusió i els potencials de reducció de semicel·les.
- Voltamperometria de redissolució anòdica - Un mètode d'anàlisi quantitativa per a l'anàlisi de traces de cations metàl·lics. L'analit es diposita (electrolíticament) sobre l'elèctrode de treball durant una etapa de deposició, i després s'oxida durant l'etapa d'extracció. El corrent es mesura durant l'etapa d'extracció.
- Voltamperometria de redissolució catòdica - Un mètode d'anàlisi quantitativa per a l'anàlisi de traces d'anions. Quan s'aplica un potencial positiu, es produeix l'oxidació de l'elèctrode de mercuri i la formació de precipitats insolubles dels anions. Un potencial negatiu redueix llavors (tires) de la pel·lícula (tires) dipositada en la solució.
- Voltamperometria de redissolució d'adsorció - Un mètode d'anàlisi quantitativa per a l'anàlisi de traces. L'analit es diposita simplement per adsorció a la superfície de l'elèctrode (és a dir, sense electròlisi), i després s'electrolitza per donar el senyal analític. S'utilitzen sovint elèctrodes modificats químicament.
- Voltamperometria de corrent altern
- Polarografia - Una subclasse de voltamperometria on l'elèctrode de treball és un elèctrode de gota de mercuri (DME), útil pel seu ampli rang catòdic i superfície renovable.
- Voltamperometria d'elèctrode rotatori - Una tècnica hidrodinàmica en la qual l'elèctrode de treball, usualment un elèctrode de disc rotatori (RDE) or l'elèctrode de disc-anell rotatori (RRDE), trencada a molt alta velocitat. Aquesta tècnica és útil per estudiar la cinètica i els mecanismes de reacció electroquímics per a una semirreacció.
- Voltamperometria de pols normal
- Voltamperometria de pols diferencial
- Cronoamperometria
Història[modifica]
El començament de la voltamperometria es va veure facilitat pel descobriment de la polarografia el 1922 per el Premi Nobel de Química Jaroslav Heyrovský. Les primeres tècniques de voltamperomètrics van tenir molts problemes, que limitaven la seva viabilitat per a l'ús diari a la química analítica. El 1942 Hickling va construir el primer Potenciostat de tres elèctrodes.[5] Els anys 1960 i 1970 van ser testimonis de molts avenços en la teoria, la instrumentació, i la introducció de sistemes afegits i controlats per ordinadors. Aquests avenços van millorar la sensibilitat i van crear nous mètodes analítics. La indústria va respondre amb la producció més barata de Potenciostats, d'elèctrodess, i de les cel que podrien ser utilitzats eficaçment en el treball analític de rutina.
Aplicacions[modifica]
- Sensors voltamperomètrics
- Comercialment es produeixen un gran nombre de sistemes de voltamperomètrics per a la determinació de determinades espècies que són d'interès en la indústria i la investigació. Aquests dispositius es denominen de vegades elèctrodes, però són, de fet, cel voltamperomètrics completes i són més conegudes com a sensors.
- Elèctrode d'oxigen
- La determinació de l'oxigen dissolt en una varietat d'entorns aquàtics, com l'aigua de mar, la sang, les aigües residuals, els efluents de plantes químiques, i els sòls és d'enorme importància per a la indústria, la investigació biomèdica i del medi ambient, i la medicina clínica. Un dels mètodes més comuns i convenients per fer aquestes mesures és el sensor de Clark, que va ser patentat per Leland Clarke Jr el 1956.
Referències[modifica]
- ↑ Kissinger, Peter; William R. Heineman. CRC. Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded. 2, 1996.01.23. ISBN 0824794451.
- ↑ Zoski, Cynthia G. Elsevier Science. Handbook of Electrochemistry, 2007.02.07. ISBN 0444519580.
- ↑ Bard, Allen J.; Larry R. Faulkner. Wiley. Electrochemical Methods: Fundamentals and Applications. 2, 2000.12.18. ISBN 0471043729.
- ↑ Nicholson, R. S.; Irving. Shaina «Theory of Stationary Electrode Polarography. Single Scan and Cíclic Methods Applied to Reversible, Irreversible, and Kinetic Systems.». Analytical Chemistry, 01-04-1964, pàg. 706-723. DOI: 10.1021/ac60210a007 [Consulta: 17 abril 2009].
- ↑ Hickling, A. «Studies in electrode polarisation. Part IV.-The automatic control of the potential of a working electrode». Transactions of the Faraday Society, 38, 1.942, pàg. 27-33 [Consulta: 12 novembre 2009].
Bibliografia[modifica]
- Reinmuth, W. H.. «12». A: Theory of Stationary Electrode Polarography. 33, 1961.11.01, p. 1793-1794. DOI 10.1021/ac60180a004 [Consulta: 16 abril 2009].
- Skoog, Douglas A.; Donald M. West, F. James Holler. Harcourt Brace College Publishers. Fundamentals of Analytical Chemistry. 7th, 1995.08.25. ISBN 0030059380.
- Zanella, P. Royal Society of Chemistry. Inorganic Electrochemistry: Theory, Practice, and Application. 1, 2003.10.01. ISBN 0854046615.
Enllaços externs[modifica]
- http://www.drhuang.com/science/chemistry/electrochemistry/polar.doc.htm
- http://www.autolab-instruments.com/download/content/Appl021.pdf
- http://www.amelchem.com/download/items/voltammetry/manuals/eng/manual_eng.pdf
- http://www.prenhall.com/settle/chapters/ch37.pdf
