Nitrat de sodi: diferència entre les revisions
→Història: Fotos |
Ampliació |
||
| Línia 2: | Línia 2: | ||
El '''nitrat de sodi''' és un compost químic amb la fórmula NaNO<sub>3</sub>. Aquesta sal també es coneix amb el nom de '''saltpetre de Xile''' (grans dipòsits del qual foren històricament minats a [[Xile]])<ref>{{ref-notícia |cognom=Mutic |nom=Anja |títol=The ghost towns of northern Chile |publicació=Washington Post |url=https://www.washingtonpost.com/lifestyle/travel/the-ghost-towns-of-northern-chile/2012/10/25/fa4adad0-16e2-11e2-a55c-39408fbe6a4b_story.html |consulta=6 abril 2020 |data=26 octubre 2012}}</ref> per distingir-lo de saltpetre ordinari, [[nitrat de potassi]]. La forma mineral també es coneix com a [[nitratina]]. |
El '''nitrat de sodi''' és un compost químic amb la fórmula NaNO<sub>3</sub>. Aquesta sal també es coneix amb el nom de '''saltpetre de Xile''' (grans dipòsits del qual foren històricament minats a [[Xile]])<ref>{{ref-notícia |cognom=Mutic |nom=Anja |títol=The ghost towns of northern Chile |publicació=Washington Post |url=https://www.washingtonpost.com/lifestyle/travel/the-ghost-towns-of-northern-chile/2012/10/25/fa4adad0-16e2-11e2-a55c-39408fbe6a4b_story.html |consulta=6 abril 2020 |data=26 octubre 2012}}</ref> per distingir-lo de saltpetre ordinari, [[nitrat de potassi]]. La forma mineral també es coneix com a [[nitratina]]. |
||
El nitrat de sodi és un sòlid blanc molt soluble en aigua. És una font de fàcil accés |
El nitrat de sodi és un sòlid blanc molt soluble en aigua. És una font de fàcil accés de l'anió nitrat (NO<sub>3</sub><sup>-</sup>), útil en diverses reaccions realitzades a escala industrial per a la producció d'adobs, pirotècnia i bombes de fum, vidre i esmalts de ceràmica, conservant d'aliments i propulsor sòlid de coets. Ha estat minat àmpliament amb aquests propòsits. |
||
== Estat natural == |
== Estat natural i obtenció == |
||
[[Fitxer:Atacama map.svg|esquerra|miniatura|Desert d'Atacama]] |
[[Fitxer:Atacama map.svg|esquerra|miniatura|Desert d'Atacama]] |
||
Hi ha grans dipòsits del mineral [[nitratina]], constituïda per nitrat de sodi, al [[desert d'Atacama]], al nord de [[Xile]], una regió de gairebé 650 km de nord a sud i de 50 a 65 km d'ample. La nitratina es troba damunt la roca sedimentària [[Calitx (geologia)|calitx]], amb gruixes que van d'uns pocs centímetres fins a un metre o més. El calitx és generalment de mig a vint metres per sota de la superfície. Els dipòsits sovint contenen traces de iodat, perclorat, cromat i dicromat, espècies altament oxidades poques vegades trobades en altres llocs a la natura. |
Hi ha grans dipòsits del mineral [[nitratina]], constituïda per nitrat de sodi, al [[desert d'Atacama]], al nord de [[Xile]], una regió de gairebé 650 km de nord a sud i de 50 a 65 km d'ample. La nitratina es troba damunt la roca sedimentària [[Calitx (geologia)|calitx]], amb gruixes que van d'uns pocs centímetres fins a un metre o més. El calitx és generalment de mig a vint metres per sota de la superfície. Els dipòsits sovint contenen traces de iodat, perclorat, cromat i dicromat, espècies altament oxidades poques vegades trobades en altres llocs a la natura. |
||
[[Fitxer:Nitratine-548175.jpg|miniatura|Nitratina]] |
[[Fitxer:Nitratine-548175.jpg|miniatura|Nitratina]] |
||
L'origen d'una quantitat tan gran de nitrat de sodi s'ha investigat àmpliament, però no hi ha consens. L'únic acord és que el desert d'Atacama és tan sec que en formar-se el nitrat de sodi no es renta per precipitacions o nevades. A causa de la coneguda formació de nitrat dels fems, un dels primers suggeriments fou que els nitrats es produïen a partir de [[guano]] fòssil. Tanmateix s'ha demostrat que no hi ha hagut suficient guano. Més recentment, un estudi de foto-reaccions químiques de nitrogen atmosfèric en diversos deserts les sorres van mostrar la reducció a NH4+ i oxidació a NOx−. Els dipòsits d'Atacama foren considerats únics fins al 1962 quan es descobrí un dipòsit similar al llarg del marge occidental del [[mar de Ross]] a l'[[Antàrtida]]. La zona és seca, ventosa, a uns 600 metres sobre la mar i no conté cap guano fòssil. Com el dipòsit d'Atacama el nitrat de sodi es produeix en un calitx de tres a cinc centímetres per sota de la superfície i conté traces de iodat.<ref name=":0">{{Ref-publicació|article=Some History of Nitrates|url=http://dx.doi.org/10.1021/ed080p1393|publicació=Journal of Chemical Education|data=2003-12|issn=0021-9584|pàgines=1393|volum=80|exemplar=12|doi=10.1021/ed080p1393|nom=Dennis W.|cognom=Barnum}}</ref> |
L'origen d'una quantitat tan gran de nitrat de sodi s'ha investigat àmpliament, però no hi ha consens. L'únic acord és que el desert d'Atacama és tan sec que en formar-se el nitrat de sodi no es renta per precipitacions o nevades. A causa de la coneguda formació de nitrat dels fems, un dels primers suggeriments fou que els nitrats es produïen a partir de [[guano]] fòssil. Tanmateix s'ha demostrat que no hi ha hagut suficient guano. Més recentment, un estudi de foto-reaccions químiques de nitrogen atmosfèric en diversos deserts les sorres van mostrar la reducció a NH4+ i oxidació a NOx−. Els dipòsits d'Atacama foren considerats únics fins al 1962 quan es descobrí un dipòsit similar al llarg del marge occidental del [[mar de Ross]] a l'[[Antàrtida]]. La zona és seca, ventosa, a uns 600 metres sobre la mar i no conté cap guano fòssil. Com el dipòsit d'Atacama el nitrat de sodi es produeix en un calitx de tres a cinc centímetres per sota de la superfície i conté traces de iodat.<ref name=":0">{{Ref-publicació|article=Some History of Nitrates|url=http://dx.doi.org/10.1021/ed080p1393|publicació=Journal of Chemical Education|data=2003-12|issn=0021-9584|pàgines=1393|volum=80|exemplar=12|doi=10.1021/ed080p1393|nom=Dennis W.|cognom=Barnum}}</ref> |
||
Actualment s'obté majoritàriament per reacció de l'[[àcid nítric]] i [[carbonat de sodi]]: |
|||
<chem display="block">2 HNO3 + Na2CO3 -> 2 NaNO3 + H2O + CO2</chem> |
|||
== Història == |
== Història == |
||
[[Fitxer:Oficinas salitreras de Humberstone y Santa Laura, Chile, 2016-02-11, DD 51.jpg|miniatura|Oficines salnitreres d'Humberstone i Santa Laura]] |
[[Fitxer:Oficinas salitreras de Humberstone y Santa Laura, Chile, 2016-02-11, DD 51.jpg|miniatura|Oficines salnitreres d'Humberstone i Santa Laura]] |
||
Entre 1810 i 1812, els dipòsits naturals del [[desert d'Atacama]], situat aleshores al [[Virregnat del Perú]], foren explotats pels espanyols prop de la ciutat de Zapiga, a un centenar de quilòmetres al sud de l'actual frontera amb el [[Perú]], per a produir pólvora. Aquesta és la part més septentrional i accessible del desert d'Atacama. Més al sud, el desert queda tallat del mar per una costa de muntanyes que s'eleven abruptament entre 300 i 600 m des del mar, dificultant l'accés al desert interior. Els llits de nitrats de sodi no foren explotats àmpliament fins al 1830 quan els enviaments tant de nitrat de sodi com de guano a Europa començaren, principalment per [[Adob|adobs]] en lloc de municions. Els agricultors europeus tot just començaven a apreciar el valor dels fertilitzants en aquell moment. Per a explosius, el nitrat de sodi es convertia en nitrat de potassi dissolent-lo en aigua calenta i afegir clorur de potassi. Sobre potes de refrigeració el nitrat de potassi cristal·litza: |
Entre 1810 i 1812, els dipòsits naturals del [[desert d'Atacama]], situat aleshores al [[Virregnat del Perú]], foren explotats pels espanyols prop de la ciutat de Zapiga, a un centenar de quilòmetres al sud de l'actual frontera amb el [[Perú]], per a produir pólvora. Aquesta és la part més septentrional i accessible del desert d'Atacama. Més al sud, el desert queda tallat del mar per una costa de muntanyes que s'eleven abruptament entre 300 i 600 m des del mar, dificultant l'accés al desert interior. Els llits de nitrats de sodi no foren explotats àmpliament fins al 1830 quan els enviaments tant de nitrat de sodi com de guano a Europa començaren, principalment per [[Adob|adobs]] en lloc de municions. Els agricultors europeus tot just començaven a apreciar el valor dels fertilitzants en aquell moment. Per a explosius, el nitrat de sodi es convertia en nitrat de potassi dissolent-lo en aigua calenta i afegir clorur de potassi. Sobre potes de refrigeració el nitrat de potassi cristal·litza: |
||
[[Fitxer:Nitrato de Chile 01 by-dpc.jpg|miniatura|Cartell publicitari difós a Espanya i Portugal, obra de l'arquitecte Adolfo López-Duran Lozano (1902-?), realitzat essent estudiant a la [[Institución Libre de Enseñanza]].<ref>{{Ref-web|url=http://www.memoriachilena.gob.cl/602/articles-123277_recurso_2.pdf|títol=La Publicidad del nitrato de Chile en el primer tercio del siglo XX. Ejemplos de Art Deco en el Valle del Henares. Azulejería, cerámica y publicidad|consulta=23 abril 2021|cognom=Barbas Nieto-Laina|nom=Ricardo L.}}</ref>]] |
|||
[[Fitxer:Nitrato de Chile 01 by-dpc.jpg|miniatura]] |
|||
En el moment de la [[Guerra Civil americana]], la Unió va bloquejar ports del sud per evitar que la Confederació finançàs la guerra amb el cotó exportat i la importació de materials de guerra com el nitrat de Xile. Els estats del sud van recórrer a l'antic mètode d'extreure'l dels sòls de brutícia de les cavernes. El 1826 Bolívia s'independitzà del Perú, quedant els dipòsits de nitrats en territori bolivià, que en aquell moment arribaven al mar. Tanmateix les empreses xilenes i britàniques posseïen les mines i els treballadors eren principalment xilens. A uns 400 quilòmetres al sud, Xile va començar a extreure nitrats a finals de la dècada de 1850. Quan es descobrí que els jaciments més importants estaven a l'interior del desert, s'inicià una disputa fronterera entre Xile i Bolívia. El resultat fou la [[Guerra del Pacífic (1879-1883)|Guerra del Pacífic]] (1879-1883) en què Xile s'enfrontà a una aliança de Bolívia i el Perú. Xile guanyà la guerra i aconseguí tots els jaciments de nitrats.<ref name=":0" /> |
En el moment de la [[Guerra Civil americana]], la Unió va bloquejar ports del sud per evitar que la Confederació finançàs la guerra amb el cotó exportat i la importació de materials de guerra com el nitrat de Xile. Els estats del sud van recórrer a l'antic mètode d'extreure'l dels sòls de brutícia de les cavernes. El 1826 Bolívia s'independitzà del Perú, quedant els dipòsits de nitrats en territori bolivià, que en aquell moment arribaven al mar. Tanmateix les empreses xilenes i britàniques posseïen les mines i els treballadors eren principalment xilens. A uns 400 quilòmetres al sud, Xile va començar a extreure nitrats a finals de la dècada de 1850. Quan es descobrí que els jaciments més importants estaven a l'interior del desert, s'inicià una disputa fronterera entre Xile i Bolívia. El resultat fou la [[Guerra del Pacífic (1879-1883)|Guerra del Pacífic]] (1879-1883) en què Xile s'enfrontà a una aliança de Bolívia i el Perú. Xile guanyà la guerra i aconseguí tots els jaciments de nitrats.<ref name=":0" /> |
||
A l'esclat de la [[Primera Guerra Mundial]], les potències aliades van prendre mesures per evitar que Alemanya importés nitrat de Xile. No obstant això, Alemanya inicià la producció a gran escala d'amoníac a través del [[Procés de Haber-Bosch|procés Haber-Bosch]], seguit de l'oxidació a l'àcid nítric pel procés Ostwald, la qual cosa allargà la guerra dos o tres anys, ja que Alemanya s'hauria quedat sense nitrats per produir explosius. Després de la Primera Guerra Mundial, el procés Haber-Ostwald es convertí en la font més econòmica de nitrat i la mineria xilena acabà gairebé el 1930.<ref name=":0" /> |
A l'esclat de la [[Primera Guerra Mundial]], les potències aliades van prendre mesures per evitar que Alemanya importés nitrat de Xile. No obstant això, Alemanya inicià la producció a gran escala d'amoníac a través del [[Procés de Haber-Bosch|procés Haber-Bosch]], seguit de l'oxidació a l'àcid nítric pel procés Ostwald, la qual cosa allargà la guerra dos o tres anys, ja que Alemanya s'hauria quedat sense nitrats per produir explosius. Després de la Primera Guerra Mundial, el procés Haber-Ostwald es convertí en la font més econòmica de nitrat i la mineria xilena acabà gairebé el 1930.<ref name=":0" /> |
||
== Propietats == |
|||
=== Propietats físiques === |
|||
[[Fitxer:Dusičnan sodný.JPG|miniatura|Mostra de nitrat de sodi]] |
|||
El nitrat de sodi a temperatura ambient és un sòlid cristal·lí, de color blanc i inodor. Els cristalls són trigonals o romboèdrics. El seu punt de fusió és de 308 °C i descompon a 380 °C en òxid de dinitrogen i òxid de sodi. La seva densitat és de 2,26 g/cm³. És molt soluble en aigua, 73 g en 100 g d'aigua a 0 °C i 91,2 g en 100 g d'aigua a 25 °C. La seva solubilitat augmenta amb la temperatura. És soluble en etanol i metanol. Les seves dissolucions en aigua són neutres (pH = 7). En aire humit és deliqüescent.<ref>{{Ref-web|títol=Sodium nitrate|url=https://pubchem.ncbi.nlm.nih.gov/compound/24268|consulta=2021-04-23|llengua=en|cognom=PubChem}}</ref> |
|||
== Usos == |
== Usos == |
||
El nitrat de sodi es consumeix principalment en vidre, explosius, indústria agrícola, química i altres. El vidre és el camp d'aplicació més gran, que va trigar aproximadament el 47,42% el 2017. L'explosiu també és una aplicació important de nitrat de sodi que s'utilitza principalment a Amèrica del Sud. El nitrat de sodi també es consumeix àmpliament a la indústria agrícola a Europa i als EUA.<ref>{{Ref-web|títol=Sodium Nitrate Market Share 2021 Developments, Industry Size, Types, Applications, Major Regions, Top Key Players and Forecast to 2026|url=https://www.thecowboychannel.com/story/43315853/sodium-nitrate-market-share-2021-developments-industry-size-types-applications-major-regions-top-key-players-and-forecast-to-2026|consulta=2021-04-23|llengua=en}}</ref> |
|||
=== Alimentació === |
=== Alimentació === |
||
El nitrat de sodi s'utilitza a la indústria alimentària com a [[conservant]] (E-251) |
El nitrat de sodi s'utilitza a la indústria alimentària com a [[conservant]] (E-251) |
||
Revisió del 11:01, 23 abr 2021
|
|
Aquest article o secció s'està elaborant i està inacabat. L'usuari Antoni Salvà hi està treballant i és possible que trobeu defectes de contingut o de forma. Comenteu abans els canvis majors per coordinar-los. Aquest avís és temporal: es pot treure o substituir per {{incomplet}} després d'uns dies d'inactivitat. Fou afegit el abril de 2021. |
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 84,978 Da |
| Rol | cancerigen |
| Estructura química | |
| Fórmula química | NaNO₃ |
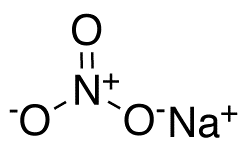 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 2,257 g/cm³ |
| Punt de fusió | 308 °C 307 °C |
| Punt de descomposició | 380 °C |
| Entalpia estàndard de formació | −257 kJ/mol |
| Perill | |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Identificador Kemler | 50 |
El nitrat de sodi és un compost químic amb la fórmula NaNO3. Aquesta sal també es coneix amb el nom de saltpetre de Xile (grans dipòsits del qual foren històricament minats a Xile)[1] per distingir-lo de saltpetre ordinari, nitrat de potassi. La forma mineral també es coneix com a nitratina.
El nitrat de sodi és un sòlid blanc molt soluble en aigua. És una font de fàcil accés de l'anió nitrat (NO3-), útil en diverses reaccions realitzades a escala industrial per a la producció d'adobs, pirotècnia i bombes de fum, vidre i esmalts de ceràmica, conservant d'aliments i propulsor sòlid de coets. Ha estat minat àmpliament amb aquests propòsits.
Estat natural i obtenció

Hi ha grans dipòsits del mineral nitratina, constituïda per nitrat de sodi, al desert d'Atacama, al nord de Xile, una regió de gairebé 650 km de nord a sud i de 50 a 65 km d'ample. La nitratina es troba damunt la roca sedimentària calitx, amb gruixes que van d'uns pocs centímetres fins a un metre o més. El calitx és generalment de mig a vint metres per sota de la superfície. Els dipòsits sovint contenen traces de iodat, perclorat, cromat i dicromat, espècies altament oxidades poques vegades trobades en altres llocs a la natura.

L'origen d'una quantitat tan gran de nitrat de sodi s'ha investigat àmpliament, però no hi ha consens. L'únic acord és que el desert d'Atacama és tan sec que en formar-se el nitrat de sodi no es renta per precipitacions o nevades. A causa de la coneguda formació de nitrat dels fems, un dels primers suggeriments fou que els nitrats es produïen a partir de guano fòssil. Tanmateix s'ha demostrat que no hi ha hagut suficient guano. Més recentment, un estudi de foto-reaccions químiques de nitrogen atmosfèric en diversos deserts les sorres van mostrar la reducció a NH4+ i oxidació a NOx−. Els dipòsits d'Atacama foren considerats únics fins al 1962 quan es descobrí un dipòsit similar al llarg del marge occidental del mar de Ross a l'Antàrtida. La zona és seca, ventosa, a uns 600 metres sobre la mar i no conté cap guano fòssil. Com el dipòsit d'Atacama el nitrat de sodi es produeix en un calitx de tres a cinc centímetres per sota de la superfície i conté traces de iodat.[2]
Actualment s'obté majoritàriament per reacció de l'àcid nítric i carbonat de sodi:
Història

Entre 1810 i 1812, els dipòsits naturals del desert d'Atacama, situat aleshores al Virregnat del Perú, foren explotats pels espanyols prop de la ciutat de Zapiga, a un centenar de quilòmetres al sud de l'actual frontera amb el Perú, per a produir pólvora. Aquesta és la part més septentrional i accessible del desert d'Atacama. Més al sud, el desert queda tallat del mar per una costa de muntanyes que s'eleven abruptament entre 300 i 600 m des del mar, dificultant l'accés al desert interior. Els llits de nitrats de sodi no foren explotats àmpliament fins al 1830 quan els enviaments tant de nitrat de sodi com de guano a Europa començaren, principalment per adobs en lloc de municions. Els agricultors europeus tot just començaven a apreciar el valor dels fertilitzants en aquell moment. Per a explosius, el nitrat de sodi es convertia en nitrat de potassi dissolent-lo en aigua calenta i afegir clorur de potassi. Sobre potes de refrigeració el nitrat de potassi cristal·litza:

En el moment de la Guerra Civil americana, la Unió va bloquejar ports del sud per evitar que la Confederació finançàs la guerra amb el cotó exportat i la importació de materials de guerra com el nitrat de Xile. Els estats del sud van recórrer a l'antic mètode d'extreure'l dels sòls de brutícia de les cavernes. El 1826 Bolívia s'independitzà del Perú, quedant els dipòsits de nitrats en territori bolivià, que en aquell moment arribaven al mar. Tanmateix les empreses xilenes i britàniques posseïen les mines i els treballadors eren principalment xilens. A uns 400 quilòmetres al sud, Xile va començar a extreure nitrats a finals de la dècada de 1850. Quan es descobrí que els jaciments més importants estaven a l'interior del desert, s'inicià una disputa fronterera entre Xile i Bolívia. El resultat fou la Guerra del Pacífic (1879-1883) en què Xile s'enfrontà a una aliança de Bolívia i el Perú. Xile guanyà la guerra i aconseguí tots els jaciments de nitrats.[2]
A l'esclat de la Primera Guerra Mundial, les potències aliades van prendre mesures per evitar que Alemanya importés nitrat de Xile. No obstant això, Alemanya inicià la producció a gran escala d'amoníac a través del procés Haber-Bosch, seguit de l'oxidació a l'àcid nítric pel procés Ostwald, la qual cosa allargà la guerra dos o tres anys, ja que Alemanya s'hauria quedat sense nitrats per produir explosius. Després de la Primera Guerra Mundial, el procés Haber-Ostwald es convertí en la font més econòmica de nitrat i la mineria xilena acabà gairebé el 1930.[2]
Propietats
Propietats físiques

El nitrat de sodi a temperatura ambient és un sòlid cristal·lí, de color blanc i inodor. Els cristalls són trigonals o romboèdrics. El seu punt de fusió és de 308 °C i descompon a 380 °C en òxid de dinitrogen i òxid de sodi. La seva densitat és de 2,26 g/cm³. És molt soluble en aigua, 73 g en 100 g d'aigua a 0 °C i 91,2 g en 100 g d'aigua a 25 °C. La seva solubilitat augmenta amb la temperatura. És soluble en etanol i metanol. Les seves dissolucions en aigua són neutres (pH = 7). En aire humit és deliqüescent.[4]
Usos
El nitrat de sodi es consumeix principalment en vidre, explosius, indústria agrícola, química i altres. El vidre és el camp d'aplicació més gran, que va trigar aproximadament el 47,42% el 2017. L'explosiu també és una aplicació important de nitrat de sodi que s'utilitza principalment a Amèrica del Sud. El nitrat de sodi també es consumeix àmpliament a la indústria agrícola a Europa i als EUA.[5]
Alimentació
El nitrat de sodi s'utilitza a la indústria alimentària com a conservant (E-251)
Referències
- ↑ Mutic, Anja «The ghost towns of northern Chile». Washington Post, 26-10-2012 [Consulta: 6 abril 2020].
- ↑ 2,0 2,1 2,2 Barnum, Dennis W. «Some History of Nitrates». Journal of Chemical Education, 80, 12, 2003-12, pàg. 1393. DOI: 10.1021/ed080p1393. ISSN: 0021-9584.
- ↑ Barbas Nieto-Laina, Ricardo L. «La Publicidad del nitrato de Chile en el primer tercio del siglo XX. Ejemplos de Art Deco en el Valle del Henares. Azulejería, cerámica y publicidad». [Consulta: 23 abril 2021].
- ↑ PubChem. «Sodium nitrate» (en anglès). [Consulta: 23 abril 2021].
- ↑ «Sodium Nitrate Market Share 2021 Developments, Industry Size, Types, Applications, Major Regions, Top Key Players and Forecast to 2026» (en anglès). [Consulta: 23 abril 2021].

