Òxid de titani(IV)
 | |
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 79,938 Da |
| Rol | material biocompatible, photosensitizer (en) |
| Estructura química | |
| Fórmula química | TiO₂ |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 4,26 g/cm³ (a 20 °C) |
| Punt de fusió | 1.850 °C 1.830 °C 1.843 °C |
| Punt d'ebullició | 3.000 °C (a 760 Torr) 2.500 °C (a 760 Torr) |
| Pressió de vapor | 0 mmHg (a 20 °C) |
| Perill | |
| Límit d'exposició mitjana ponderada en el temps | 15 mg/m³ (8 h, Estats Units d'Amèrica) |
| Límit d'exposició sostre | 0 mg/m³ (cap valor) |
| IDLH | 5.000 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
L'òxid de titani(IV) o diòxid de titani és un compost de titani que es troba de manera natural, la fórmula del qual és TiO2. A la natura es troba formant els minerals rútil, anatasa i brookita, entre d'altres. S'utilitza com a pigment blanc de codi PW6, com a catalitzador, i com a absorbent de la radiació ultraviolada, entre altres aplicacions. Quan es fa servir com colorant alimentari té el codi E E171 i en cosmètica el codi CI77891.
Història[modifica]

El mineralogista austríac Ignaz Edler von Born (1742-1791) fou el primer qui descrigué el primer mineral de diòxid de titani, el rútil, al seu catàleg (1772: 34), com a Basaltes crystallisatus ruber. La localitat proporcionada per von Born fou Murán, prop de Revúca (Eslovàquia).[1]


El primer òxid de titani fou aïllat el 1791 en una remota vila de Cornualla, al sud-oest d'Anglaterra, pel reverend William Gregor (1761-1817), que era el vicari de Creed. Gregor observà que una sorra negra que havia trobat al costat d'un rierol a la parròquia veïna de Manaccan era atreta per un imant. L'analitzà tan bé com pogué i deduí que estava composta per dos òxids metàl·lics, un l'òxid de ferro, que explicava les propietats magnètiques, i un altre òxid que no era atret, i que no pogué identificar. Gregor conclogué que havia descobert un metall desconegut fins aleshores i ho comunicà a la Royal Geological Society of Cornwall, i també a l'edició de 1791 de la revista alemanya de ciència, Crell's Annalen, on suggerí anomenar el nou mineral manaccanita, en honor al nom de la parròquia on l'havia trobat. És un mineral posteriorment anomenat ilmenita FeTiO3. Si hagués estat capaç d'aïllar el metall, i demostrar que era un element «nou», es diu que hauria pensat a anomenar-lo manaccin.[2] Quatre anys més tard, el 1795, l'eminent científic alemany Martin Heinrich Klaproth (1743–1817), de Berlín, redescobrí el mateix element, i l'anomenà titani, derivat dels Titans, fills d'Urà i Gea, de la mitologia grega. Elegí aquest nom perquè en si mateix no tenia cap significat, per tant, «no podia donar lloc a cap idea errònia». Klaproth obtingué l'òxid metàl·lic d'una mostra de rútil, que li havien enviat des d'Hongria. Quan li parlaren del descobriment anterior de Gregor, investigà una mostra d'ilmenita i confirmà que també contenia el mateix òxid metàl·lic, el TiO3.[2][3]

Estat natural i obtenció[modifica]
El diòxid de titani es presenta a la natura en forma de cinc minerals diferents, dels quals els més importants són: el rútil, l'anatasa i la brookita; tot i que també ho són l'akaogiïta i la riesita.[4]
El diòxid de titani s'obté majoritàriament de la ilmenita i del rútil. Segons els dipòsits, els minerals de titani poden contenir impureses que cal eliminar abans de dur a terme el procés industrial per obtenir diòxid de titani. Actualment, es demana als productors de pigments que utilitzin minerals de titani amb nivells més alts de diòxid de titani, amb l'objectiu de minimitzar els costos d'eliminació de residus i maximitzar la capacitat dels equips de processament de pigments.[5] Els dos processos convencionals són el del sulfat i el del clor.
Procés del sulfat[modifica]

El procés del sulfat empra com a material de partida la ilmenita, que conté al voltant del 50 per cent de diòxid de titani. La primera etapa d'aquest procés és una digestió on es tracta la ilmenita amb àcid sulfúric del 96 per cent i s'aconsegueix separar el ferro del titani:
A continuació l'òxid sulfat de titani(IV) format s'hidrolitza per donar òxid de titani(IV) hidratat:

Per acabar es realitza una calcinació de l'òxid de titani(IV) hidratat que es pot obtenir en forma de rútil o d'anatasa:[6]
Procés del clor[modifica]
En el procés del clor es parteix de rútil, constituït per diòxid de titani i impureses al voltant del 3 per cent, i es tracta amb clor gas, amb la qual cosa s'obté tetraclorur de titani o clorur de titani(IV), que és gas per sobre els 136,4 °C:
Seguidament, es purifica el tetraclorur de titani i, finalment, s'oxida a diòxid de titani amb oxigen gas, en forma de rútil d'alta puresa, recuperant-se el clor:[6]
Propietats[modifica]
- Cel·les unitàries del rútil i l'anatasa. En vermell els oxígens i en gris els titanis.
L'òxid de titani(IV) és un sòlid blanc cristal·lí, sense olor, amb un punt de fusió de 1 855 °C, insoluble en aigua i dissolvents orgànics. És l'únic òxid de titani natural a pressió atmosfèrica i presenta tres polimorfs: rútil, anatasa i brookita. Mentre que el rúutil és la fase estable, tant l'anatasa com la brookita són metaestables; aquesta última és difícil de sintetitzar i per això s'estudia poques vegades.[7]
Els cristalls de rútil són tetragonals, grup espacial P4/mnm, densitat 4,250 g/cm³, índex de refracció 2,79-2,903, duresa 6-6,5 (escala de Mohs), banda prohibida 3,0 eV; els d'anatasa també són tetragonals, del grup espacial I41/amd, densitat 3,894 g/cm³, índex de refracció 2,49-2,54, duresa 5,5-6 (escala de Mohs) banda prohibida 3,2 eV;[7] i els de brookita ortoròmbics, grup espacial Pcab.[8]
Aplicacions[modifica]
Pigment[modifica]

El principal ús del diòxid de titani és com a pigment blanc (codi PW6), ja que no absorbeix gairebé cap radiació incident a la regió visible de l'espectre electromagnètic (380-700 nm). El diòxid de titani té un fort poder de dispersió de la llum i dispersa la llum incident de tres maneres: reflexió superficial, refracció i difracció en el cristall. Els valors alts de l'índex de refracció permeten que els pigments de TiO2 tenguin una capacitat de cobriment molt major en revestiments o plàstics, fent que el TiO2 sigui un pigment molt millor que d'altres pigments blancs. Per tant, en les mateixes condicions, només es necessita una petita quantitat de diòxid de titani per a formar un revestiment blanc i opac. S'ha demostrat que les propietats òptiques dels pigments de diòxid de titani estan relacionades amb la seva mida de partícula, essent l'òptima d'aproximadament 250 nm. El TiO2 és inert, no tòxic, estable i poc costós. Més del 50 per cent de tots els pigments de TiO2 produïts són consumits per la indústria dels recobriments, i aproximadament un quart per la indústria paperera. L'11 per cent s'utilitza en plàstics; una petita part restant s'utilitza en tintes i altres usos finals. Les partícules de diòxid de titani optimitzades amb mida i amb tractaments superficials tenen un excel·lent poder de cobriment, brillantor i altres característiques importants com la resistència a la degradació química. El rútil és més resistent a la llum ultraviolada que l'anatasa i es prefereix per a pintures, plàstics, especialment per a aplicacions a l'aire lliure. L'anatasa és menys abrasiva i es fa servir principalment en pintures d'interior i en la fabricació de paper. El TiO2 es tracta superficialment amb un o més òxids inorgànics com alumini, sílice, zirconi o una combinació d'aquests òxids inorgànics, i compostos orgànics com alcohol polihídric per obtenir les propietats requerides de dispersió, fotoactivitat i opacitat necessàries per a una aplicació específica.[10]

Producció d'energia[modifica]
La tecnologia actual per a la conversió de la llum solar en energia elèctrica és predominantment basada en cèl·lules solars d'estat sòlid de silici. En els últims anys, han sorgit noves cèl·lules solars basades en materials semiconductors que ofereixen la possible alternativa tecnològica amb perspectives de fabricació econòmica i flexibilitat. El TiO2 nanoestructurat ha estat el principal material semiconductor per a aquesta nova generació de cèl·lules solars. En aquesta tecnologia, s'utilitza un sensibilitzador d'electrons que absorbeix en la regió visible per injectar portadors de càrrega a través de la junta semiconductor-electròlit cap al TiO2 per millorar l'eficiència de conversió de l'energia solar, ja que el TiO2, amb la seva banda prohibida de 3,2 eV, només absorbeix la part ultraviolada de l'energia solar. Aquest tipus de cèl·lules solars, anomenades cèl·lules solars sensibilitzades amb colorant (DSSCs, per les seves sigles en anglès) han mostrat un alt rendiment i tenen el potencial de ser econòmiques.[10]
El 1972, Fujishima i Honda descobriren el fenomen de l'escissió fotocatalítica de l'aigua en un elèctrode de diòxid de titani sota la llum ultraviolada. Comparat amb altres fotocatalitzadors, el TiO2 és molt més prometedor perquè és estable, no corrosiu, respectuós amb el medi ambient, abundant i econòmicament eficient.[10]
El sistema i la tecnologia de les bateries d'ions liti han representat un canvi revolucionari en el camp de les bateries d'alimentació. Els materials de l'ànode basats en òxids de titani són candidats prometedors com a materials alternatius als ànodes carbonosos, gràcies als avantatges en termes de cost, seguretat i toxicitat.[10]
Catalitzador[modifica]
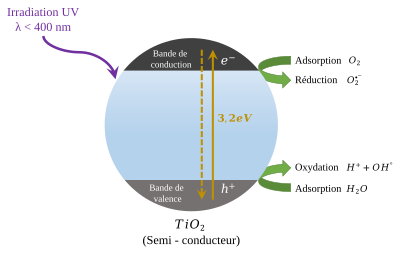
Especialment en la seva forma anatasa, el diòxid de titani és un fotocatalitzador sota la llum ultraviolada.[11] El seu fort potencial redox oxida l'aigua i crea radicals hidroxils. També pot oxidar oxigen o materials orgànics directament per això s'afegeix a diversos productes com pintures o finestres per esterilitzar o desodoritzar i es fa servir com a catalitzador en la hidròlisi. Una altra aplicació important del TiO2 nanoestructurat és en el tractament de l'aigua, aprofitant les seves propietats fotocatalítiques. El TiO2 s'ha utilitzat en la descomposició fotocatalítica de tints orgànics en aigües residuals i de contaminants orgànics com pesticides i productes farmacèutics en altres aigües contaminades. El TiO2 s'ha considerat la millor opció per ser utilitzat com a fotocatalitzador, ja que el TiO2 és químicament inert i econòmic de fabricar i aplicar.[10]

El TiO₂ s'utilitza com a suport en catalitzadors comercials V₂O5-WO₃/TiO₂ per a la reducció catalítica selectiva (SCR) d'òxids de nitrogen NOx. En la tecnologia SCR, les emissions de gasos àcids NOx altament indesitjables de diverses fonts industrials es redueixen a nitrogen i aigua. Els catalitzadors V₂O5-WO₃/TiO₂ s'utilitzen àmpliament en aplicacions comercials per la seva excel·lent estabilitat tèrmica i la seva menor activitat d'oxidació per a la conversió de diòxid de sofre a triòxid de sofre.[10]
Protecció solar[modifica]

Protector solar de la pell i absorbidor de llum ultraviolada, es fa servir en cosmètics i en tatuatges, es troba en gairebé totes les cremes protectores solars amb el codi CI77891 perquè té un elevat índex de refracció. El TiO₂ té un alt índex de refracció que permet que dispersi la llum visible. El mètode actual de tractament preventiu contra la radiació UV nociva implica suspendre una substància que absorbeix o dispersa la radiació UV en una emulsió densa, coneguda com a protector solar. El diòxid de titani és un ingredient dels protectors solars, i la seva concentració sovint oscil·la entre el 2 per cent i el 15 per cent. Els protectors solars solen contenir filtres químics, que són compostos orgànics que absorbeixen fortament la radiació UV (sovint UVB), i filtres físics com el TiO2 i el ZnO que bloquegen la radiació UVA i UVB del sol a través de l'absorció, la reflexió i la dispersió.[10]
Aditiu alimentari[modifica]
El diòxid de titani s'utilitza com a colorant alimentari (E171) i, com passa amb tots els colorants alimentaris, la seva funció és fer que els aliments siguin més atractius visualment, donar color a aliments que altrament serien incolors o tornar-los el seu aspecte original. Les principals categories d'aliments que contribueixen a l'exposició dietètica de l'E171 són els productes de fleca fina, les sopes, els brous i les salses (pel que fa als nadons, els nens petits i els adolescents), i les sopes, els brous, les salses, les amanides i les pastes salades per a entrepans (nens, adults i ancians). Els fruits de closca processats són també una de les principals categories d'aliments que contribueixen a l'exposició dels adults i la gent gran. Després de fer una revisió de totes les proves científiques pertinents disponibles, l'Autoritat Europea de Seguretat Alimentària, EFSA, no descartà la seva genotoxicitat,[12] per la qual cosa el 2022 fou prohibit a la Unió Europea com a aditiu alimentari.[13]
Referències[modifica]
- ↑ «Rutile». Mindat.org. [Consulta: 18 setembre 2023].
- ↑ 2,0 2,1 Emsley, John. Nature's building blocks : an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ Challoner, Jack. Los elementos. La nueva guía ilustrada de los componentes básicos del universo. (en castellà). Alcobendas: LIBSA, 2018, p. 41,42. ISBN 9788466236669.
- ↑ «Anatase». Mindat.org. [Consulta: 12 febrer 2024].
- ↑ Gázquez, Manuel Jesús; Moreno, Silvia María Pérez; Bolívar, Juan Pedro. 9 - TiO2 as white pigment and valorization of the waste coming from its production. Elsevier, 2021, p. 311–335. DOI 10.1016/b978-0-12-819960-2.00011-0. ISBN 978-0-12-819960-2.
- ↑ 6,0 6,1 Sampath, A. H. Janaka; Wickramasinghe, Nadeera Dilshan; de Silva, K. M. Nalin; de Silva, Rohini M. «Methods of Extracting TiO2 and Other Related Compounds from Ilmenite» (en anglès). Minerals, 13, 5, 2023-05, pàg. 662. DOI: 10.3390/min13050662. ISSN: 2075-163X.
- ↑ 7,0 7,1 Hanaor, Dorian A. H.; Sorrell, Charles C. «Review of the anatase to rutile phase transformation» (en anglès). Journal of Materials Science, 46, 4, 2011-02, pàg. 855–874. DOI: 10.1007/s10853-010-5113-0. ISSN: 0022-2461.
- ↑ PubChem. «Titanium Dioxide» (en anglès). [Consulta: 18 setembre 2023].
- ↑ Francesco Parrino (ed.), Leonardo Palmisano (ed.). Titanium dioxide (TiO₂) and its applications. Amsterdam Kidlington, Oxford Cambridge, MA: Elsevier, 2021. ISBN 978-0-12-819960-2.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 Wu, Xiaoping. Applications of Titanium Dioxide Materials (en anglès). IntechOpen, 2022-03-02. DOI 10.5772/intechopen.99255. ISBN 978-1-83969-475-2.
- ↑ Kurtoglu M. E., Longenbach T., Gogotsi Y. «Preventing Sodium Poisoning of Photocatalytic TiO2 Films on Glass by Metal Doping». International Journal of Applied Glass Science, 2, 2, 2011, pàg. 108–116. DOI: 10.1111/j.2041-1294.2011.00040.x.
- ↑ «Dióxido de titanio: el uso como aditivo alimentario de E171 ya no se considera seguro» (en castellà). EFSA, 06-05-2021. [Consulta: 19 setembre 2023].
- ↑ «Dióxido de titanio (E171)» (en espanyol europeu). Agència Catalana de Seguretat Alimentària. [Consulta: 19 setembre 2023].







