Neuroserpina
La Neuroserpina és una proteïna inhibidora de serina proteases que forma part de la superfamília de les serpines. En els humans està codificada pel gen SERPIN1 que té 9 exons i està localitzat en el cromosoma 3.[1]

Dins de la superfamília de les serpines podem trobar moltes proteïnes que tenen una estructura similar i mecanismes d’acció comuns ja que la majoria són inhibidors extracel·lulars de serina proteases. Totes elles es pleguen formant una conformació metaestable i durant la inhibició de la proteasa canvien de forma, és a dir, són proteïnes que tenen una clara relació entre estructura i funció.
Pel que fa a l’estructura comuna que comparteixen, les serpines tenen tres fulles beta (A, B i C) i un bucle central reactiu (RCL) que és flexible i està exposat. En el RCL hi ha un punt específic d’escissió implicat en el mecanisme d’inhibició de les serina proteases.[2]
El fet que l’estructura molecular sigui tant flexible permet la funció de les serpines i al mateix temps fa que sigui susceptible de patir mutacions puntuals. Com a conseqüència es poden formar polímers i quan aquests s’acumulen al reticle endoplasmàtic, formen els cossos d’inclusió que són la causa de les serpinopaties. Les manifestacions clíniques de les serpinopaties seran diferents i específiques de cada serpina i poden ser degudes tant per guany de funció com per pèrdua de funció de la serpina.[3]
Concretament en el cas de la neuroserpina, els polímers d’aquesta proteïna estan relacionats amb determinades patologies com l'alzheimer, el càncer i la preeclàmsia, així com també amb l’aparició de la malaltia neurodegenerativa FENIB (encefalopatia familiar amb cossos d’inclusió de neuroserpina).
Descobriment[modifica]
La neuroserpina es va descobrir fa més de 30 anys en neurones dels ganglis de l’arrel dorsal d’embrions de pollastre i des de llavors ha estat investigada pel seu paper neuroprotector en lesions isquèmiques cerebrals. Es va veure que els axons d’aquestes neurones secretaven aquesta proteïna de 410 aminoàcids i més tard es va classificar com un membre dins del grup de la família de les serpines.[4]
Característiques[modifica]
Localització[modifica]
Respecte a la localització, la neuroserpina la trobem principalment al cervell i a la medul·la espinal. També la podem trobar de forma secundària al fetge, ronyó, pàncrees, testicles i cèl·lules del sistema immunitari (macròfags, cèl·lules dendrítiques, cèl·lules NK, limfòcits B i T...).[3]
Funció biològica[modifica]
La seva funció és a nivell extracel·lular, ja que inhibeix les serina proteases que es troben al torrent sanguini com la quimiotripsina.
Es considera que el paper fisiològic de la neuroserpina és actuar sobre la proteasa activadora tissular del plasminogen (tPA), ja que s’ha vist que aquesta és fortament inhibida per la neuroserpina i sembla que les dues estan coexpressades en el sistema nerviós central. Alguns estudis han demostrat que l’activitat de tPA es veu disminuïda en els cervells de ratolins transgènics que sobreexpressen neuroserpina.[5]
Podem considerar que la neuroserpina és un regulador del creixement i de la plasticitat neuronal.
Estructura[modifica]
Les neuroserpines humanes comparteixen una alta seqüència i homologia estructural amb altres membres de la superfamília de les serpines, així com el mecanisme canònic de la família per a la inhibició de proteases. Les molècules individuals de serpina (monòmers) poden adoptar tres conformacions diferents: nativa, latent i escindida.[3]

La neuroserpina nativa presenta un plec de serpina típic, amb un nucli de tres fulles β grans, nou hèlixs α i un bucle central reactiu (RCL); i a diferència d'altres serpines presenta un bucle omega flexible i una hèlix F desestabilitzada. El bucle central reactiu actua com a pseudosubstrat per a l'enzim objectiu (tPA). Després, la proteasa no només s'uneix al bucle sinó que l'escindeix, alliberant-lo de la neuroserpina, la qual cosa desecandena una sèrie de canvis conformacionals a la neuroserpina; on la proteasa unida es desplaça des de la part superior de la molècula a la inferior. Mentre la proteasa es reubica, el bucle central reactiu (escindit) s'insereix en una estructura interna de la serpina, coneguda com a làmina β A, aquest moviment atrapara la proteasa inactivant-la permanentment.[6] La neuroserpina escindida, després de la inactivació del tPA, presenta una estructura semblant a la de l'α1-antitripsina (AAT).
L'estructura exacta i els detalls moleculars de la neuroserpina latent i dels polímers de neuroserpina encara no s'han determinat.
Cross-talk amb altres senyalitzadors[modifica]
A més de la neuroserpina, hi ha altres senyalitzadors que juntament amb ella exerceixen rols fonamentals en el sistema nerviós. Entre els més importants es destaquen el tPA i uPA, que són activadors del plasminogen amb diverses funcions en el sistema nerviós com la migració cel·lular, la plasticitat neuronal o la neurogènesi; i els seus inhibidors, PAI-1 i PN-1.

A més d'aquestes, també és essencial conèixer les funcions d'altres enzims com la trombina, els seus receptors (PAR 1-4), i el seu inhibidor serpí PN-1. L'equilibri entre la trombina i el PN-1 és vital per a la dinàmica de la sinapsi i la modulació de la morfologia dels astròcits.[7] La serpina C1 també té presència en el teixit cerebral normal i s'expressa a la microglia humana i a les línies cel·lulars de neuroblastoma. La neuropsina i la neurotripsina també tenen un paper important en la fisiologia i malalties del sistema nerviós. Neuropsina s'expressa principalment a les neurones del sistema límbic adult, i els seus nivells d'expressió canvien després de l'estimulació elèctrica, cosa que suggereix la seva implicació en la plasticitat de l'hipocamp relacionada amb l'aprenentatge, la memòria i la cognició.[6]
Importància biomèdica[modifica]
Alzheimer[modifica]
La neuroserpina juga un paper crític en la patogènesi de la malaltia de l’Alzheimer ja que regula l’expressió i l’acumulació de la proteïna beta amiloide (Aβ).[8] La neuroserpina forma un complex binari amb Aβ1-42, el que inactiva la neuroserpina com a inhibidor del tPA (tissue plasminogen activator) i bloqueja el procés de polimerització. Tot i això, la neuroserpina també té el paper d’accelerar el procés d’acumulació de Aβ.[9]
D’una banda, estudis in vitro han demostrat que la neuroserpina atenua la neurotoxicitat induïda per Aβ.[9] Per tant, la interacció entre neuroserpina i Aβ indueix la formació d’un oligòmer no tòxic que protegeix a les neurones de l’Alzheimer.
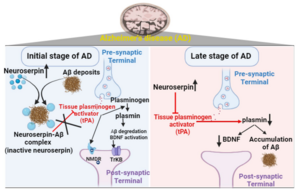
D’altra banda, un experiment va il·lustrar que ratolins deficients en neuroserpina tenien una major reducció en l’acumulació de Aβ1-42, suggerint el possible paper de la neuroserpina en l’agregació de Aβ en el desenvolupament de la malaltia d’Alzheimer.[10] Una expressió més alta de neuroserpina inhibeix el tPA neuroprotector i la generació de plasmina amb la reducció de la Aβ. L’eliminació de neuroserpina en ratolins millora la eliminació de Aβ i redueix la seva acumulació mitjançant l’activació de tPA.[10]
Degut a estudis contradictoris encara no se sap del tot si la neuroserpina és neuroprotectora o participa en la progressió de la malaltia.
Hi ha observacions que proposen que un increment de l’expressió de la neuroserpina en estats inicials de la malaltia podria ser protector contra l’agregació i acumulació de Aβ. Tot i això, nivells incrementats de neuroserpina en estadis més tardans de la malaltia podrien augmentar la severitat de la malaltia mitjançant la inhibició de tPA i activitat de plasmina.[9]
Càncer[modifica]
S’ha demostrat que la neuroserpina està implicada en la mediació del creixement tumoral, la metàstasi i les vies de supervivència cel·lular. S’ha vist que la neuroserpina estava sobre expressada en teixits de càncer de pròstata poc diferenciat, en comparació amb teixit de càncer de pròstata sa i ben diferenciat. L’alta expressió de neuroserpina es va associar a una taxa de supervivència menor i una major recurrència.[11]
Tot i això, en el càncer d'estómac, es va veure que la neuroserpina podia tenir un efecte protector, ja que una sobre expressió de neuroserpina induïa un arrest en G1/S i disminuïa el creixement de cèl·lules.[12]
A més, s’ha demostrat que els inhibidors d’activadors de plasminogen, com la neuroserpina, tenen un paper fonamental en la metàstasi cerebral. Les cèl·lules canceroses han de bloquejar els senyals letals dels astròcits després de travessar la barrera hematoencefàlica i després han d’establir interaccions amb els capil·lars cerebrals per poder fer expansió metastàtica. Es va veure que les cèl·lules metastàtiques del cervell que provenien de càncer de pulmó i mama expressaven alts nivells de serpines activadores d’antiplasminògen, entre d’elles neuroserpina. Això inhibia la generació de plasmina, disminuïa l’escissió de FasL i L1CAM, afavorint la metàstasi cap al cervell en aquests tipus de tumors.[13]
FENIB[modifica]
Mutacions puntuals en el gen SERPINI1 donen lloc una malaltia neurològica rara i incurable, anomenada FENIB (encefalopatia familiar amb cossos d’inclusió de neuroserpina). Aquesta és una patologia d’herència autosòmica dominant que condueix progressivament a la neurodegeneració. Amb símptomes de deteriorament cognitiu, tremolors, epilèpsia, demència, mioclònia i disàrtria.[14]
Les formes mutades de neuroserpina donen lloc a la formació espontània de polímers. Aquests s’acumulen al lumen del reticle endoplasmàtic de les neurones, en forma de cossos d’inclusió (o cossos de Collins); localitzats majoritàriament a les capes més profundes de l’escorça i la substància negra del cervell.[14]

La polimerització de la neuroserpina dona com a resultat la pèrdua de funció d’aquesta. S'ha vist que un excés de tPA en el sistema nerviós central pot causar la mort cel·lular mediada per toxines; per tant disminuirà la supervivència neuronal. Alhora, l’acumulació d’aquests polímers té efectes nocius en les neurones i pot acabar també en la mort neuronal.[5]
Avui dia s’han descobert un total de 6 mutacions que poden causar aquesta patologia: Ser49Pro, Ser52Arg, His338Arg, Gly392Glu, Gly392Arg i Leu47Pro. Les mutacions puntuals es donen als residus conservats del full-B A. Allà es produirà un canvi d’aminoàcid (mutació missense), que desestabilitzarà la proteïna i el full-B A.[3]

La mutació Ser49Pro va ser la primera descrita; trobada en membres d'una família de Syracuse (Nova York), que presentaven signes de demència als cinquanta anys. També existeix el cas d’una altra familia que vivía a Portland, que descriu la mutació Ser52Arg; aquesta es caracteritza per una aparició precoç, símptomes més greus i un major nombre d'inclusions cerebrals. Diferents estudis indiquen una correlació entre la gravetat de la mutació, és a dir el grau d’inestabilitat de la proteïna, i l’acumulació de polímers. Així com l’aparició de la malaltia a una menor edat i la gravetat que aquesta comporta.[14]
També s’han realitzat estudis per investigar la resposta cel·lular en FENIB. Les formes mutants de neuroserpina seran degradades principalment per sistemes de degradació associats al reticle endoplasmàtic (ERAD). Però quan aquesta via es veu saturada, es formaran polímers de la proteïna al lumen del reticle, causant els característics cossos d’inclusió. Això dona lloc a l’activació d’una via de senyalització d’estrés (o sobrecàrrega) del reticle, on l’activació depenent de calci del factor NF-kB i l’augment d’estrés oxidatiu, promouran la inflamació i mort de la cèl·lula.[3] [5]
Preeclàmpsia[modifica]
Altres àmbits en que s’està investigant la impotància i ús de la neuroserpina és com a biomarcador.Actualment aquesta proteïna s’està postulant com a possible biomarcador de la preeclàmpsia temprana (abans de les 34 setmanes de gestació).
Actualment el tractament i seguiment d’aquesta patologia depèn de diferents factors i condicions. En un estudi s’aborda el paper que té la neuroserpina en aquesta patologia, ja que és un fort inhibidor del tPA. Aquest estudi cas-control es va realitzar a Brasil, amb dades de les institucions públiques nacionals. Volien observar si els nivells de neuroserpina en sang estaven alterats; i si aquests permetien diferenciar la forma temprana de la tardana de preeclàmpsia. Alhora també van fer una correlació entre aquests nivells i l’edat materna (factor de risc). Van realitzar immunoassaigs per tal de determinar la quantitat (ng/ml) de neuroserpina en plasma.
Com a resultats van observar que les dones embarassades amb preeclàmpsia tenien nivells més baixos de neuroserpina, comparat amb dones embarassades normotenses. No es van observar canvis respecte a l'edat materna, per tant aquesta condició (els baixos nivells de neuroserpina) és independent a l’edat de la mare; tot i que l’edat materna sí és un factor de risc per a la preeclàmpsia.
I com a resultat més important, van obtenir que les dones embarassades amb preeclàmpsia d'inici precoç, produeixen nivells sistèmics més baixos de neuroserpina; en comparació amb les dones amb la forma clínica d'aparició tardana. Això suggereix que la baixada de neuroserpina podria contribuir a la patogènesi de la preeclàmpsia severa d'inici precoç; i per tant, aquesta molècula podria ser un bon biomarcador per a aquesta condició clínica.[15]
Referències[modifica]
- ↑ Schrimpf SP, Bleiker AJ, Brecevic L et al (1997) Human neuroserpin (PI12): cDNA cloning and chromosomal localization to 3q26. Genomics 40:55–62. https://doi.org/10.1006/geno.1996. 4514
- ↑ Sarkar, Anindya; Zhou, Crystal; Meklemburg, Robert; Wintrode, Patrick L. «Local conformational flexibility provides a basis for facile polymer formation in human neuroserpin». Biophysical Journal, 101, 7, 05-10-2011, pàg. 1758–1765. DOI: 10.1016/j.bpj.2011.08.037. ISSN: 1542-0086. PMC: 3183757. PMID: 21961602.
- ↑ 3,0 3,1 3,2 3,3 3,4 D'Acunto, Emanuela; Fra, Annamaria; Visentin, Cristina; Manno, Mauro; Ricagno, Stefano «Neuroserpin: structure, function, physiology and pathology». Cellular and molecular life sciences: CMLS, 78, 19-20, 2021-10, pàg. 6409–6430. DOI: 10.1007/s00018-021-03907-6. ISSN: 1420-9071. PMC: 8558161. PMID: 34405255.
- ↑ D'Acunto, Emanuela; Fra, Annamaria; Visentin, Cristina; Manno, Mauro; Ricagno, Stefano «Neuroserpin: structure, function, physiology and pathology». Cellular and molecular life sciences: CMLS, 78, 19-20, 2021-10, pàg. 6409–6430. DOI: 10.1007/s00018-021-03907-6. ISSN: 1420-9071. PMC: 8558161. PMID: 34405255.
- ↑ 5,0 5,1 5,2 Lee, Tet Woo; Tsang, Vicky W.K.; Loef, Evert Jan; Birch, Nigel P. «Physiological and pathological functions of neuroserpin: Regulation of cellular responses through multiple mechanisms» (en anglès). Seminars in Cell & Developmental Biology, 62, 2017-02, pàg. 152–159. DOI: 10.1016/j.semcdb.2016.09.007.
- ↑ 6,0 6,1 Miranda E, Lomas DA. «Neuroserpin: a serpin to think about.». Miranda E, Lomas DA. Neuroserpin: a serpin to think about. Cell Mol Life Sci. 2006;63(6):709-722. doi:10.1007/s00018-005-5077-4. DOI: 10.1007/s00018-005-5077-4.
- ↑ panelVictoria L Turgeon a, Lucien J Houenou «The role of thrombin-like (serine) proteases in the development, plasticity and pathology of the nervous system». The role of thrombin-like (serine) proteases in the development, plasticity and pathology of the nervous system. DOI: 10.1016/s0165-0173(97)00015-5.
- ↑ HS, Sharma; L, Feng; JV, Lafuente; DF, Muresanu; ZR, Tian «TiO2-nanowired delivery of mesenchymal stem cells thwarts diabetes-induced exacerbation of brain pathology in heat stroke». CNS & Neurological Disorders - Drug Targets, 14, 999, 25-02-2015, pàg. 1–1. DOI: 10.2174/1871527314666150225130829. ISSN: 1871-5273.
- ↑ 9,0 9,1 9,2 Kinghorn, Kerri J.; Crowther, Damian C.; Sharp, Lynda K.; Nerelius, Charlotte; Davis, Richard L. «Neuroserpin Binds Aβ and Is a Neuroprotective Component of Amyloid Plaques in Alzheimer Disease». Journal of Biological Chemistry, 281, 39, 2006-09, pàg. 29268–29277. DOI: 10.1074/jbc.m600690200. ISSN: 0021-9258.
- ↑ 10,0 10,1 Fabbro, Shay; Schaller, Kristin; Seeds, Nicholas W. «Amyloid‐beta levels are significantly reduced and spatial memory defects are rescued in a novel neuroserpin‐deficient Alzheimer’s disease transgenic mouse model». Journal of Neurochemistry, 118, 5, 18-07-2011, pàg. 928–938. DOI: 10.1111/j.1471-4159.2011.07359.x. ISSN: 0022-3042.
- ↑ Hasumi, Hisashi; Ishiguro, Hitoshi; Nakamura, Masashi; Sugiura, Shinpei; Osada, Yutaka «Neuroserpin (PI‐12) is upregulated in high‐grade prostate cancer and is associated with survival». International Journal of Cancer, 115, 6, 18-02-2005, pàg. 911–916. DOI: 10.1002/ijc.20967. ISSN: 0020-7136.
- ↑ Yamanaka S, Olaru AV, An F et al (2012) MicroRNA-21 inhibits Serpini1, a gene with novel tumour suppressive efects in gastric cancer. Dig Liver Dis 44:589–596. doi:10.1016/j.dld.2012.02.016
- ↑ Valiente, Manuel; Obenauf, Anna C.; Jin, Xin; Chen, Qing; Zhang, Xiang H.-F. «Serpins Promote Cancer Cell Survival and Vascular Co-Option in Brain Metastasis» (en anglès). Cell, 156, 5, 2014-02, pàg. 1002–1016. DOI: 10.1016/j.cell.2014.01.040. PMC: PMC3988473. PMID: 24581498.
- ↑ 14,0 14,1 14,2 Miranda, E.; Lomas, D. A. «Neuroserpin: a serpin to think about» (en anglès). Cellular and Molecular Life Sciences CMLS, 63, 6, 2006-03, pàg. 709–722. DOI: 10.1007/s00018-005-5077-4. ISSN: 1420-682X.
- ↑ Perucci, Luiza Oliveira; da Silva, Sirlaine Pio Gomes; Bearzoti, Eduardo; de Castro Pinto, Kelerson Mauro; Alpoim, Patrícia Nessralla «Neuroserpin: A potential biomarker for early-onset severe preeclampsia» (en anglès). Immunobiology, 228, 2, 2023-03, pàg. 152339. DOI: 10.1016/j.imbio.2023.152339.